Legge Ritchter-Wenzel Cosa sono, storie, dichiarazioni, esempi
- 3070
- 403
- Ruth Cattaneo
IL Legge Ritchter-Wenzel o delle proporzioni reciproche è quella che stabilisce che le proporzioni di massa tra due composti consentono di determinare quello di un terzo composto. È una delle leggi della stechiometria, insieme alla legge di Lavoisier (legge della conservazione della massa); la legge Proust (legge delle proporzioni definite); e la legge di Dalton (legge di molteplici proporzioni).
Ritcher enunciò la sua legge nel 1792 in un libro che definiva le basi della stechiometria, basate sul lavoro di ricerca di Carl F Wenzel, che nel 1777 pubblicò la prima tabella di equivalenza per acidi e basi.
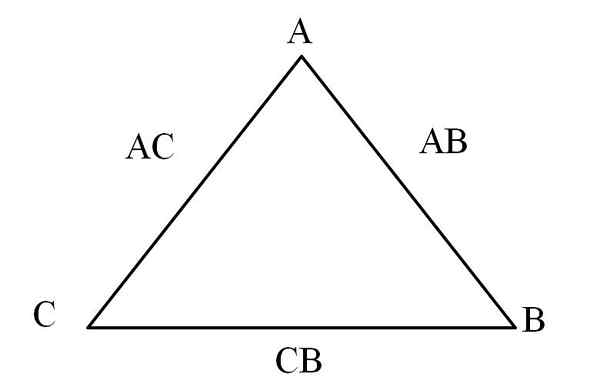
 Triangolo reciprocità. Fonte: Gabriel Bolívar
Triangolo reciprocità. Fonte: Gabriel Bolívar Un modo semplice per visualizzarlo è attraverso un "triangolo reciprocamente" (immagine superiore). Se sono note le masse di A, C e B che sono miscelate per formare i composti AC e AB, si può determinare quanto di C e B vengono miscelati o reagiti per formare il composto CB.
Nei composti AC e AB l'elemento A è presente in entrambi, quindi quando si dividono le loro proporzioni di massa è quanto C reagisce con B.
[TOC]
Storia e generalità della legge delle proporzioni reciproche
Richter ha scoperto che la proporzione di peso dei composti consumati in una reazione chimica è sempre la stessa.
A questo proposito, Ritcher ha scoperto che 615 parti sono richieste in peso di magnesia (MGO), ad esempio, per neutralizzare 1000 parti in peso di acido solforico.
Tra il 1792 e il 1794, Ritcher pubblicò un riassunto di tre volumi che conteneva il suo lavoro sulla legge delle proporzioni definite. Il riassunto ha provato la stechiometria, definendola come l'arte delle misurazioni chimiche.
Può servirti: cromatografia a strati fine: caratteristiche, a cosa serveIndicando, inoltre, che la stechiometria si occupa delle leggi in base alle quali le sostanze sono unite per formare composti. Tuttavia, i lavori di ricerca di Richter sono stati criticati per il trattamento matematico che ha usato, notando che ha adattato i suoi risultati.
Nel 1802, Ernst Gottfried Fischer pubblicò la prima tabella di equivalenti chimici, che usava l'acido solforico con la figura di 1000; Simile al valore trovato da Richter, per la neutralizzazione dell'acido solforico da parte della magnesia.
Tuttavia, è stato sottolineato che Richter ha costruito una tabella di Pesos di combinazione che indicano la proporzione in cui un numero di composti ha reagito. Ad esempio, è indicato che 859 parti NaOH neutralizzano 712 parti di HNO3.
Dichiarazioni e conseguenze
La dichiarazione della legge di Richter-Wenzel è la seguente: le masse di due diversi elementi che sono combinati con la stessa quantità di un terzo elemento, mantengono la stessa relazione delle masse di tali elementi se combinate tra loro.
Questa legge consentiva di stabilire il peso equivalente o il gramma di peso-rasatura, come la quantità di un elemento o un composto che reagirà con una quantità fissa di una sostanza di riferimento.
Richter chiamato pesi combinati correlati ai pesi degli elementi combinati con ogni grammo di idrogeno. I pesi di combinazione relativa di Richter corrispondono a quello che è attualmente noto come peso equivalente degli elementi o dei composti.
In conformità con l'approccio precedente, la legge di Richter-Wenzel può essere dichiarata come segue:
I pesi combinati di diversi elementi che sono combinati con un certo peso di un dato elemento sono i pesi di combinazione relativi di tali elementi se combinati tra loro, o multipli o sottomulini di queste relazioni di quantità.
Può servirti: metodi di separazione di miscele eterogeneeEsempi
Cloruro di calcio
Nell'ossido di calcio (CAO), 40 g di calcio sono combinati con 16 g di ossigeno (O). Nel frattempo, nell'ossido ipocloroso (CL2O) 71 g di cloro sono combinati con 16 g di ossigeno. Quale composto si forma di calcio se combinato con cloro?
Usando il triangolo della reciprocità, l'ossigeno è l'elemento comune per i due composti. Le proporzioni di massa dei due composti ossigenati sono determinate per prime:
40G CA/16 GO = 5G CA/2G OR
71G CL/16G o
E ora dividendo le due proporzioni di massa di CAO e CL2O avremo:
(5G CA/2G O)/(71G Cl/16G O) = 80G CA/142G CL = 40G CA/71G CL
Si noti che la legge delle proporzioni di massa è soddisfatta: 40 g di calcio reagiscono con 71 g di cloro.
Ossidi di zolfo
L'ossigeno e lo zolfo reagiscono con il rame per dare rispettivamente rame (CUO) e solfuro di rame (CUS). Quanta zolfo reagirebbe con ossigeno?
Nell'ossido di rame, 63,5 g di rame sono combinati con 16 g di ossigeno. Nel solfuro di rame, 63,5 g di rame sono uniti a 32 g di zolfo. Dividendo le proporzioni di massa che abbiamo:
(63,5 g Cu/16G O)/(63,5 g Cu/32G S) = 2032G S/1016G O = 2G S/1G OR
La proporzione di massa 2: 1 è un multiplo di 4 (63,5/16), che mostra che la legge di Richter è soddisfatta. Con questa proporzione, si ottiene il monossido di zolfo (32 g di zolfo reagito con 16 g di ossigeno).
Se questa proporzione è divisa per due, ci sarà 1: 1. Ancora una volta, ora sono 4 o 2, e quindi è il SO2, biossido di zolfo (32 g di zolfo reagisce con 32 g di ossigeno).
Può servirti: fucosa: caratteristiche, struttura, funzioniSolfuro e ossido di ferro
Il solfuro di ferro (FES) viene reagito, in cui 32 g di zolfo sono combinati con 56 g di ferro, con ossido ferroso (brutto), in cui 16 g di ossigeno sono combinati con 56 g di ferro. Questo elemento funge da riferimento.
In Fes e brutti composti reagenti, lo zolfo (S) e l'ossigeno (O) in relazione al ferro (fede) si trovano in proporzione 2: 1. Nell'ossido solforoso (SO) 32 g di zolfo sono combinati con 16 g di ossigeno, quindi lo zolfo e l'ossigeno si trovano in proporzione 2: 1.
Ciò indica che la legge delle proporzioni reciproche o la legge di Richter è soddisfatta.
La proporzione trovata tra zolfo e ossigeno nell'ossido di zolfo (2: 1) potrebbe essere usata, ad esempio, per calcolare la quantità di ossigeno reagisce con 15 g di zolfo.
O Ossigeno G = (15 g di s) ∙ (1g di O/2G di S) = 7,5g
Riferimenti
- Legge della proporzione reciproca: definizione ed esempio. Studio. Recuperato da: studio.com
- Legge delle proporzioni reciproche. Chimica librettexts. Recuperato da: Chem.Librettexts.org

