Caratteristiche di leucina, struttura, funzioni, biosintesi
- 4427
- 1244
- Kayla Serr
IL Leucina È uno dei 22 aminoacidi che costituiscono le proteine degli organismi viventi. Questo appartiene a uno dei 9 aminoacidi essenziali che non sono sintetizzati dal corpo e devono essere consumati con alimenti ingeriti nella dieta.
La leucina fu descritta per la prima volta nel 1818 dal farmacista e chimico francese. L. Proust, che lo ha definito "ossido-caso". Più tardi, Erlenmeyer e Kunlin, lo prepararono dall'α-benzoilamido-β-isopropilacrilico, la cui formula molecolare è C6H13NO2NO2.
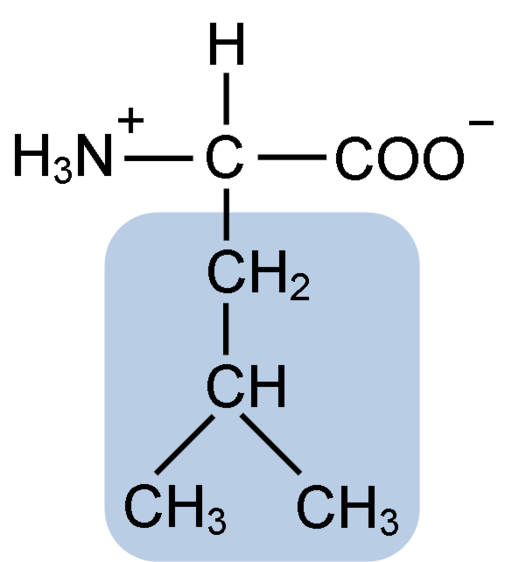
 Struttura chimica dell'amminoacido leucina (Fuene: clavecina [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] via Wikimedia Commons)
Struttura chimica dell'amminoacido leucina (Fuene: clavecina [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] via Wikimedia Commons) La leucina è stata la chiave durante la scoperta del senso di traduzione proteica, poiché la sua struttura idrofobica ha permesso al biochimico Howard Dentzis di contrassegnare in modo radioattivo l'idrogeno del carbonio 3 e osservare il significato in cui gli aminoacidi sono incorporati nella sintesi peptidica.
Le proteine note come "cerniera" o "chiusure" di leucina sono, insieme alle "dita di zinco", i più importanti fattori di trascrizione degli organismi eucariotici. Le cerniere di leucina sono caratterizzate dalle loro interazioni idrofobiche con il DNA.
Generalmente, le proteine ricche di leucina o costituite da aminoacidi ramificati non sono metabolizzate nel fegato, invece, vanno direttamente ai muscoli dove vengono rapidamente utilizzate per la sintesi proteica e ottengono energia.
La leucina è un aminoacido della catena ramificata necessaria per la biosintesi delle proteine e degli aminoacidi del latte, che sono sintetizzati nelle ghiandole mammelle. Puoi trovare grandi quantità di questo aminoacido libero all'interno del latte materno.
Tra tutti gli aminoacidi che compongono le proteine, la leucina e l'arginina sono i più abbondanti ed entrambi sono stati rilevati nelle proteine di tutti i regni che compongono l'albero della vita.
[TOC]
Caratteristiche
La leucina è conosciuta come l'amminoacido essenziale della catena ramificata, condivide la struttura tipica con gli altri aminoacidi. Tuttavia, si distingue perché la sua catena laterale o il gruppo R ha due carboni collegati e l'ultimo è collegato a un atomo di idrogeno e due gruppi metilici.
Appartiene al gruppo di aminoacidi polari senza carico, i sostituenti o i gruppi R di questi aminoacidi sono natura idrofobica e non polare. Questi aminoacidi sono i principali responsabili delle interazioni idrofobiche intra-proteiche e tendono a stabilizzare la struttura delle proteine.
Tutti gli aminoacidi, con un carbonio centrale chirale (carbonio α), ovvero ha quattro diversi sostituenti uniti, possono essere trovati in due diversi modi in natura; Pertanto, ci sono d e l-leucina, quest'ultimo tipico nelle strutture proteiche.
Entrambe le forme di ciascun aminoacido hanno proprietà diverse, partecipano a diverse rotte metaboliche e possono persino modificare le caratteristiche delle strutture di cui fanno parte.
Ad esempio, la leucina in L-lecina ha un sapore leggermente amaro, mentre nella sua forma di leucina è molto dolce.
La forma di qualsiasi aminoacido è più facile da metabolizzare dal corpo dei mammiferi. La L-Leucina è facilmente degradata e sfruttata per la costruzione e la protezione delle proteine.
Struttura
La leucina è composta da 6 atomi di carbonio. Il carbonio centrale, comune in tutti gli aminoacidi, è collegato a un gruppo carbossilico (COOH), un gruppo amminico (NH2), un atomo di idrogeno (H) e una catena laterale o un gruppo R R composto da 4 atomi di carbonio.
Può servirti: mesotelioGli atomi di carbonio all'interno degli aminoacidi possono essere identificati con lettere greche. La numerazione inizia dal carbonio dell'acido carbossilico (COOH), mentre l'annotazione con l'alfabeto greco inizia dal carbonio centrale.
La leucina ha come gruppo sostituente nella sua catena R a un gruppo isobutil o 2-metilpropil che è prodotto dalla perdita di un atomo di idrogeno, con la formazione di un radicale alchilico; Questi gruppi appaiono come ramificazioni nella struttura degli aminoacidi.
Funzioni
La leucina è un aminoacido che può fungere da precursore chetogenico di altri composti coinvolti nel ciclo dell'acido citrico. Questo aminoacido rappresenta una fonte importante per la sintesi di acetil-CoA o acetoacetil-CoA, che fanno parte delle rotte di formazione dei corpi chetonici nelle cellule epatiche.
È noto che la leucina è indispensabile nelle rotte di segnalazione dell'insulina, il che partecipa all'inizio della sintesi proteica ed evita la perdita di proteina a causa della degradazione.
Di solito, le strutture interne delle proteine sono composte da aminoacidi idrofobici come leucina, valina, isoleucina e metodo. Tali strutture sono generalmente conservate per gli enzimi comuni tra gli organismi viventi, come nel caso del citocromo c.
La leucina può attivare le rotte metaboliche nelle cellule della ghiandola mammaria per stimolare la sintesi del lattosio, i lipidi e le proteine che svolgono funzioni come le molecole di segnalazione nella regolazione dell'omeostasi energetica dei giovani mammiferi.
I domini ricchi di leucina sono una parte essenziale delle specifiche proteine leganti il DNA, che sono generalmente diametri strutturali in modo super arruolato e che sono noti come "proteine con cerniera di leucina".
Queste proteine hanno come caratteristica distintiva un modello regolare di leucine ripetute insieme ad altri aminoacidi idrofobici che sono responsabili della regolazione dei sindacati dei fattori di trascrizione al DNA e tra diversi fattori di trascrizione.
Le proteine zip di leucina possono formare eterodimeri homo-o che le consentono.
Biosintesi
Tutti gli aminoacidi a catena ramificati, compresa la leucina, sono principalmente sintetizzati nelle piante e nei batteri. Nelle piante da fiore c'è un aumento significativo della produzione di leucina, poiché è un precursore importante per tutti i composti responsabili dell'aroma di fiori e frutti.
Uno dei fattori attribuiti alla grande abbondanza di leucina nei diversi peptidi batterici è che 6 diversi codoni del codice genetico codificano per la leucina (UUA-UUG-UCU-CUC-CUA), lo stesso vale anche per l'arginina.
La leucina è sintetizzata nei batteri da una via a cinque fasi che utilizza come punto di partenza un ketacide relativo alla valina.
Questo processo è regolato in modo alostico, in modo che quando c'è un eccesso di leucina all'interno del cellulare, inibisce gli enzimi che partecipa alla rotta e interrompe la sintesi.
Può servirti: indice Simpson: formula, interpretazione ed esempioVia biosintetica
La biosintesi della leucina nei batteri inizia con la conversione di un ketacide derivato della valina, il 3-metil-2-oxobutanoat in (2S) -2-isopropilmalato, grazie all'azione dell'enzima 2-isopropilmalto synta, che usano acetilico -Coa e acqua a tale scopo.
Il (2S) -2-isopropilmalaato perde una molecola d'acqua e viene trasformato in 2-isopropilmaleato mediante 3-isopropilmalato deidratasi. Successivamente, lo stesso enzima aggiunge un'altra molecola d'acqua e trasforma il 2-isopropilmaleato in (2R-3S) -3-isopropilm.
Quest'ultimo composto è sottoposto a una reazione di ossido di ossiduzione che merita la partecipazione di una molecola NAD+, che produce (2S) -2-isopropil-3-ossosuccinazione, che è possibile con la partecipazione dell'enzima 3-isopropilmalato delebrogenasi.
(2S) -2-osopropil-3-ossosuccinazione perde un atomo di carbonio nella forma di CO2 spontaneamente, generando 4-metil-2-ossopentanoato che, mediante azione di una transaminasi di aminoacidi a catena ramificata (leucina transaminasi, specificamente) E con la concomitante liberazione di L-glutammato e 2-oxoglutarato, produce L-lecina.
Degradazione
Il ruolo principale della leucina è quello di agire come una segnalazione che dice alla cellula che ci sono sufficienti aminoacidi ed energia per iniziare la sintesi delle proteine muscolari.
Il degrado degli aminoacidi a catena ramificata mentre la leucina inizia con una transaminazione. Questo e i due successivi passaggi enzimatici sono catalizzati dai tre enzimi nel caso di leucina, isoleucina e valina.
La transaminazione dei tre aminoacidi produce i derivati α-ecotoacidici di questi, che sono soggetti a una decarbossilazione ossidativa per produrre tioé acil-COA che sono α, β-dishishrogenated per eseguire tioés de acil-coa α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α α tiva è intoplato.
Durante il catabolismo della leucina, il corrispondente scoperta di acil-COA, β-Ininsatura-Ininsatura (HMG-CoA), che è intermediario nella biosintesi del colesterolo e altri isoprenoidi.
Via catabolica di leucina
Dalla formazione dello zio Acil-CoA α, β-Insaturad che deriva dalla leucina le rotte cataboliche di questo aminoacido e la valina e l'isoleucina divergono considerevolmente.
La leucina acil-CoA Ucion α, β-inin-inintuted viene elaborata a valle da tre diversi enzimi noti come (1) 3-metilcrotonico-COA carbossilasi, (2) 3-metilglutaconil-CoA Hydratasa e (3) 3-idroxi -3-metilglutario -Coa liasa.
Nei batteri, questi enzimi sono responsabili della conversione di 3-metilcrotonici-COA (derivato della leucina) in 3-metilglutaconil-CoA, rispettivamente in 3-idrossi-3-metilglutaril-CoA e in acetoacetato e acetil-COA, rispettivamente.
La leucina disponibile nel sangue viene sfruttata per la sintesi di proteine muscolari/miofibrillari (MPS). Questo funge da fattore di attivazione di questo processo. Inoltre, interagisci direttamente con l'insulina, influenzando la fornitura del
Cibi ricchi di leucina
Il consumo di ricche proteine di aminoacidi è indispensabile per la fisiologia cellulare degli organismi viventi e la leucina non fa eccezione tra gli aminoacidi essenziali.
Le proteine ottenute dal siero lattiero-caseario sono considerate le più ricche dei residui di L-Leucina. Tuttavia, tutti gli alimenti con un alto contenuto di proteine come pesce, pollo, uova e carne rossa forniscono grandi quantità di leucina per il corpo.
Può servirti: riproduzione di virus: fasi e caratteristicheIl mais in grano è scarso nella lisina e aminoacidi triptofani, ha strutture terziarie molto rigide per la digestione e ha scarso valore dal punto di vista nutrizionale, tuttavia ha alti livelli di leucina e isoleucina.
I frutti delle piante di legumi sono ricchi di quasi tutti gli aminoacidi essenziali: lisina, treonina, isoleucina, leucina, fenilalanina e valina, ma hanno scarso contenuto di metodo e cisteina.
La leucina viene estratta, purificata e concentrata in compresse come integratori alimentari per atleti ad alta concorrenza ed è commercializzata come farmaco. La fonte principale per l'isolamento di questo aminoacido corrisponde alle farine di soia.
C'è un integratore nutrizionale usato dagli atleti per la rigenerazione muscolare noto come BCAA (inglese "Aminoacido a catena ramificata "). Ciò fornisce alte concentrazioni di aminoacidi a catena ramificata: leucina, valina e isoleucina.
Vantaggi della tua assunzione
Gli alimenti ricchi di leucina aiutano a controllare l'obesità e altre malattie metaboliche. Molti nutrizionisti sottolineano che gli alimenti ricchi di leucina e integratori nutrizionali basati su questo aminoacido contribuiscono alla regolazione dell'appetito e dell'ansia negli adulti.
Tutte le proteine ricche di leucina stimolano la sintesi delle proteine muscolari; È stato dimostrato che un aumento della proporzione di leucina ingerita rispetto agli altri aminoacidi essenziali può invertire l'attenuazione della sintesi proteica nella muscolatura dei pazienti anziani.
Anche le persone con gravi disturbi maculari paralizzati possono fermare la perdita di massa e forza muscolare con la corretta integrazione orale leucina, oltre ad applicare esercizi sistemici di resistenza muscolare.
Leucina, valina e isoleucina sono componenti essenziali della massa che costituiscono il muscolo scheletrico degli animali vertebrati, quindi la loro presenza è vitale per la sintesi di nuove proteine o per la riparazione del pre -esistente.
Disturbi da carenza
Le carenze o le malformazioni del complesso di deidrogenasi α-ZO-STOOT, che è responsabile della metabolizzazione della leucina, della valina e dell'isoleucina nell'uomo, possono causare gravi disturbi mentali.
Inoltre, esiste una condizione patologica correlata al metabolismo di questi aminoacidi a catena ramificata chiamata "malattia delle urine con odore di sciroppo di arce".
Ad oggi, l'esistenza di effetti avversi sul consumo eccessivo di leucina non è stata dimostrata. Tuttavia, si raccomanda una dose massima di 550 mg/kg al giorno.
Riferimenti
- Álava, m. D. C., Camacho, m. E., & Delgadillo, J. (2012). Salute muscolare e prevenzione della sarcopenia: l'effetto di proteina, leucina e ß-idrossi-metilbutirato. Rivista di metabolismo osseo e minerale, 10(2), 98-102.
- Fenmeme, o. R. (1993). Chimica alimentare (NO. 664: 543). Appello.
- Massey, l. K., Sokatch, j. R., & Conrad, R. S. (1976). Catabolismo aminacido a catena ramificata nei batteri. Recensioni batteriologiche, 40(1), 42.
- Mathews, c. K., & Ahern, K. G. (2002). Biochimica. Pearson Education.
- Mere, a. (1999). Supplementazione di leucina e formazione intensiva. Medicina sportiva, 27(6), 347-358.
- Munro, h. N. (Ed.). (2012). Metabolismo delle proteine dei mammiferi (Vol. 4). Elsevier
- Nelson, d. L., Lechinger, a. L., & Cox, m. M. (2008). Principi di biochimica Lechinger. Macmillan.

