Caratteristiche, struttura, funzioni, tipi di laminina
- 3001
- 909
- Silvano Montanari
IL Laminino È una delle proteine che costituisce la matrice extracellulare della membrana basale dei tessuti epiteliali negli animali vertebrati. Questo tipo di proteina fornisce un supporto di legame tra le cellule tissutali congiuntive, in modo che funzionino nella coesione e nella compattazione di questi.
Generalmente, le laminine sono responsabili dell'ordinazione dell'intricata rete proteica che forma la matrice extracellulare o la membrana del tessuto basale. Tipicamente le laminine sono associate a proteine come collagene, proteoglicani, entattine ed epar il solfato.
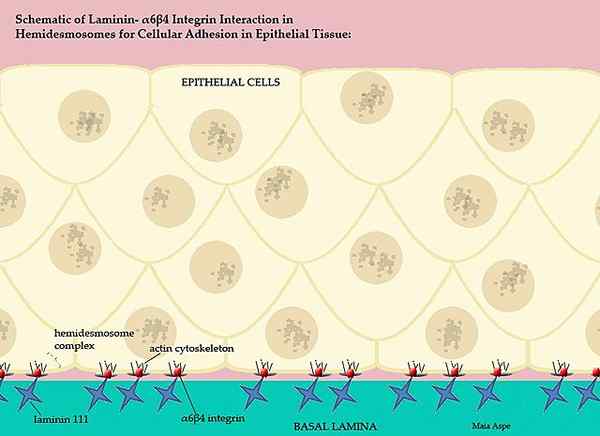
 Laminine e la loro partecipazione alla membrana vertebrata basale (fonte: Maiaaspe/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0) via Wikimedia Commons)
Laminine e la loro partecipazione alla membrana vertebrata basale (fonte: Maiaaspe/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0) via Wikimedia Commons) Questa intricata membrana basale, ordinata dalle laminine, separa le parti epiteliali dei tessuti, cioè ogni matrice extracellulare separa l'endotelio dal mesototio e la matrice extracellulare del mesotelio separa questo strato dall'epitelio epitelio.
Molte indagini hanno dimostrato che l'espressione dei geni mutati di laminine è potenzialmente letale per una cellula, poiché questi sono anche responsabili della regolazione di quasi tutte le interazioni complesse che si verificano all'interno della membrana basale.
C'è una grande diversità di famiglie di laminine in tutti i vertebrati. Questi variano in composizione, forma, funzione e origine. Nello stesso individuo, in tessuti diversi, si possono trovare diverse laminine, ciascuna adattata all'ambiente circostante del tessuto che lo esprime.
[TOC]
Caratteristiche di laminina
I monomeri o le unità laminina sono costituiti da un diverso eterotromero di catene di glicoproteine. Queste proteine contengono molti domini diversi (multidomini) e sono una parte essenziale del primo sviluppo embrionale dei tessuti.
La forma comune di laminine è una specie di "croce" o "y", sebbene alcuni abbiano una lunga forma a barra con quattro ramificazioni. Questa piccola variazione consente a ogni tipo di laminina regolare l'adeguata integrazione da qualsiasi posizione nel tessuto.
Può servirti: p-nitrofenolo: caratteristiche, usi e tossicitàLe laminine hanno un peso molecolare elevato, che può variare a seconda del tipo di laminina, da 140 a 1000 kDa.
In generale, ogni membrana basale ha uno o diversi tipi di laminine all'interno e alcuni scienziati propongono che le laminine determinino gran parte della funzione fisiologica delle membrane basali del tessuto in cui si trovano.
Negli animali dei vertebrati, sono stati trovati almeno 15 diversi tipi di laminine, classificati in una famiglia, poiché sono formati dallo stesso trimmer, ma con combinazioni diverse. Negli animali invertebrati hanno trovato tra 1 e 2 trimeri diversi.
Gli studi attuali suggeriscono che le laminine di tutti gli animali vertebrati sono nate attraverso la differenziazione degli ortologi, cioè tutti i geni che codificano per le laminine hanno un'origine comune dagli animali invertebrati.
Struttura
Nonostante il gran numero di funzioni che regolano le laminine, hanno una struttura abbastanza semplice che, per la maggior parte, è conservata tra i diversi tipi che sono noti.
Ogni laminina è costituita da tre diverse catene intrecciate tra loro che formano una sorta di "fibra intrecciata". Ciascuna delle tre catene è identificata come ALFA (α), beta (β) e gamma (γ).
La formazione del trimero di ciascuna laminina dipende dall'unione della regione C-terminale di ciascuna delle sue catene. All'interno di ogni molecola, queste catene sono abbinate attraverso collegamenti peptidici e tre ponti disolfuro che danno alla struttura una grande resistenza meccanica.
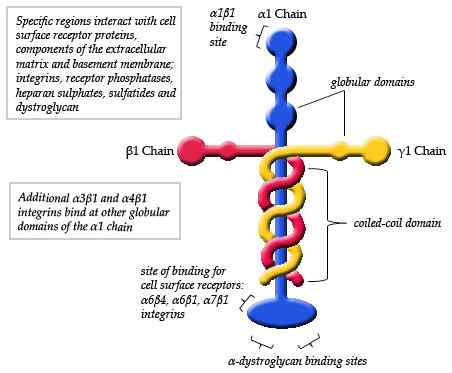 Diagramma schematico della struttura di una laminina (fonte: Maiaaspe/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0) via Wikimedia Commons)
Diagramma schematico della struttura di una laminina (fonte: Maiaaspe/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0) via Wikimedia Commons) Le osservazioni fatte mediante microscopia elettronica dei tipici monomeri di laminina hanno dettagliato che la struttura è una specie di croce asimmetrica che ha un braccio lungo di circa 77 nm (nanometri) che è caratterizzato da una forma globulare prominente a una delle sue estremità.
Può servirti: dinamica della popolazioneInoltre, si osservano tre bracci corti, due su circa 34 nm e uno di circa 48 nm. Ogni braccio termina ad un'estremità globulare, simile alla catena principale, ma di dimensioni più piccole.
La differenza tra i diversi tipi di laminine è principalmente dovuta alle differenze nelle catene α, che possono essere piegate in almeno tre modi diversi; Sebbene attualmente sono state identificate variazioni per tutte le catene:
- 5 diverse variazioni o catene di laminina α
- 3 varianti di catene β
- 3 variazioni per le catene γ
Funzioni
La funzione più importante e comunemente studiata delle laminine è quella dell'interazione con i recettori ancorati nelle membrane cellulari delle cellule adiacenti alle membrane basali in cui si trovano.
Questa interazione rende queste proteine coinvolte nella regolazione di più attività cellulari e percorsi di segnalazione. È dovuto menzionare che le loro funzioni dipendono dalla loro interazione con specifici recettori sulla superficie cellulare (molti dei recettori della membrana sono attualmente classificati in base alla loro capacità di sindaconi alle laminine).
Le integrine sono i recettori che interagiscono con le laminine e i recettori "non integrini" sono quelli che non hanno la capacità di unirsi a queste proteine. La maggior parte dei recettori "non integrini" sono proteoglicani, alcuni distroglicani o sindecani.
La maturazione dei tessuti degli organi del corpo si svolge con una sostituzione delle prime laminine, che inizialmente erano ospitate nella membrana basale dei tessuti che formavano gli organi giovanili.
All'interno delle laminine il tipo che è stato studiato di più è laminina-1, che è direttamente collegato alla crescita di assoni praticamente di qualsiasi tipo di neurone in condizioni In vitro, Poiché regolano il movimento del "cono di crescita" sulla superficie dei neuroni.
Può servirti: brodo di urea: ciò che è, fondazione, preparazione, usiNomenclatura e tipi
I biochimisti considerano la famiglia delle laminine come una famiglia molto numerosa di proteine, di cui pochi dei suoi membri sono ancora conosciuti. Tuttavia, gli strumenti moderni consentiranno di essere intravediti nuovi tipi di laminine.
Tali proteine vengono identificate ciascuna con un numero, a partire da 1 che termina la numerazione in 15 (laminina-1, laminina-2 ... laminina-15).
Viene anche utilizzato un altro tipo di nomenclatura, che indica quale tipo di catena ha ciascuna laminina. Ad esempio, la laminina -11 è composta da una catena ALFA (α) -5, da una catena beta (β) -2 e da una catena gamma (γ) -1, quindi può essere nominata laminina -521.
Inoltre, ogni laminina è classificata in base alla funzione associata a cui è associata e anche in base al tessuto corporea specifico a cui partecipa. Alcuni esempi di laminine sono:
- Lamina-1: che partecipa allo sviluppo epiteliale
- Laminina-2: coinvolto nello sviluppo miogenico di tutti i tessuti, il sistema nervoso periferico e la matrice del glomerulo.
- Lamina-3: partecipa ai sindacati my-tendinosi
- Lamina-4: funziona nei sindacati neuromuscolari e nella matrice mesangiale dei glomeruli
- Laminina-5, 6 e 7: agiscono preferibilmente nei tessuti epidermici.
Riferimenti
- Minatore, J. H., & Yurchenco, P. D. (2004). Funzioni di laminina nella morfogenesi dei tessuti. Annu. Rev. Cell Dev. Biolo., 20, 255-284.
- Rasmussen, d. G. K., & Karsdal, M. A. (2016). Laminine. In biochimica dei collageni, laminine ed elastina (PP. 163-196). Academic Press.
- Sasaki, t., Fässler, r., & Hohenester, e. (2004). Laminina: il nocciolo del gruppo membrana basale. The Journal of Cell Biology, 164 (7), 959-963.
- Timpl, r., Engel, J., & Martin, G. R. (1983). Proteina multifunzionale di laminina-A delle membrane basali. Tendenze nelle scienze biochimiche, 8 (6), 207-209.
- Timpl, r., Rohde, h., Robey, p. G., Rennard, s. Yo., Foidart, j. M., & Martin, G. R. (1979). Glicoproteina di laminina-A dalle membrane basali. Journal of Biological Chemistry, 254 (19), 9933-9937.
- Tryggvason, k. (1993). La famiglia laminina. Opinione attuale in biologia cellulare, 5 (5), 877-882.

