Caratteristiche, struttura e funzioni integrine
- 3052
- 543
- Rufo Longo
IL Integrine Sono un grande gruppo o una famiglia di proteine della superficie cellulare, apparentemente esclusiva del regno animale. Sono la principale risorsa delle cellule per mantenere l'interazione (sotto forma di adesione) con altre cellule e con la matrice cellulare.
La sua struttura è composta da due subunità chiamate alfa e beta. Nei mammiferi è noto che ci sono tra 16-18 unità alfa e 3-8 beta, che agiranno a seconda della loro combinazione, e anche allo stato fisiologico della cellula o del tessuto specifico.
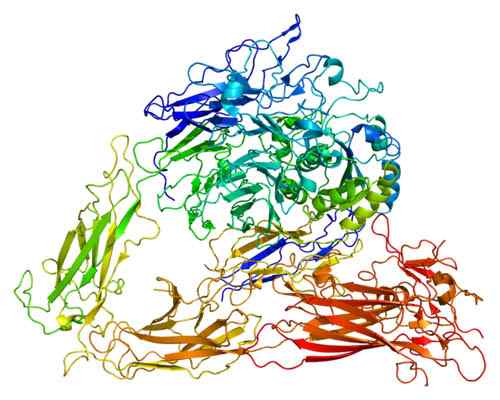 Disegno della struttura molecolare della proteina ITGB3 (integrina beta 3). Preso e curato da: EMW [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)].
Disegno della struttura molecolare della proteina ITGB3 (integrina beta 3). Preso e curato da: EMW [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Esistono diverse proteine che hanno funzioni adesive. Tuttavia, il gruppo di integrine è quello che è più distribuito e interagisce con tutte le proteine chiave della matrice cellulare. Le integrine partecipano a fagocitosi, migrazione cellulare e guarigione delle ferite e sono persino molto studiate per la loro partecipazione alle metastasi.
[TOC]
Caratteristiche
Sono proteine che sono caratterizzate da unisci meccanicamente il citocrometro cellulare. Rileva biochimicamente se è stato effettuato l'ammissione e trasducano i segnali cellulari che collegano l'ambiente extracellulare con il intracellulare, in entrambi i modi.
Lavorano o lavorano con altri recettori come immunoglobiline, caderina, selezioni e sindecandi. Per quanto riguarda i ligandi delle integrine, questi sono costituiti da fibronectina, fibrinogeno, collagene e vitronectina, tra gli altri.
L'Unione di questi ai loro ligandi è dovuta a cationi di bilancia extracellulare come calcio o magnesio. L'uso dell'uno o dell'altro dipenderà dall'integrina specifica.
Le integrine hanno una forma allungata che termina in una testa a forma di globo, che secondo le osservazioni elettroniche per la microscopia, è proiettata su oltre 20 nanometri del doppio strato lipidico.
Struttura
 Le integrine sono proteine che consentono la comunicazione tra le cellule.
Le integrine sono proteine che consentono la comunicazione tra le cellule.Fonte: Berkshire Community College Bioscience Image Library [CC0]
Le integrine sono eterodimeri, cioè sono molecole sempre costituite da due proteine. Entrambe le proteine sono considerate subunità o protomeri e sono differenziate come subunità alfa e subunità beta. Entrambe le subunità sono unite in modo non covalente. Hanno una massa molecolare tra 90 e 160 kDa.
Il numero di subunità alfa e beta varia tra i diversi gruppi di organismi nel regno animale. In insetti come la mosca della frutta (Drosophyla), ad esempio, ci sono 5 subunità alfa e 2 beta, mentre nei nematodi di genere Fallhabditis ci sono 2 alfas e una beta.
Può servirti: podociti: caratteristiche, istologia e funzioniNei mammiferi, i ricercatori suggeriscono che esiste un numero fisso di subunità e combinazioni di questi; Tuttavia, non vi è consenso nella bibliografia riguardo a questo numero. Ad esempio, alcuni menzionano che ci sono 18 subunità alfa, 8 beta e 24 combinazioni, mentre altri parlano di 16 alfa e 8 beta per 22 combinazioni.
Ogni subunità presenta la seguente struttura.
Alpha Subunidad
La subunità alfa presenta una struttura con un dominio di sette foglie o fogli che formano la testa, un dominio nella coscia, due domini del vitello, un singolo dominio transmembrana e anche una breve coda citoplasmatica che non presenta un'attività enzimatica o actina unione.
Le catene presenti con circa 1000-1200 rifiuti. Può unirsi ai cationi bivalenti.
Nei mammiferi, che è dove le integrine sono state studiate maggiormente, la subunità alfa può essere raggruppata in quanto contiene o non un dominio inserito (Alpha I).
Con il dominio inserito Alpha I
Il dominio inserito alfa I è costituito da una regione di 200 aminoacidi. La presenza di questo dominio nelle integrine, indica che sono recettori di collagene e leucociti.
Nessun dominio inserito
Le integrine alfa che non presentano il dominio integrato sono classificate in 4 sottofamilie, che vedremo di seguito.
PS1
I recettori della glucoproteina, anche chiamati laminine, sono fondamentali per integrare tessuti muscolari, reni e pelle.
PS2
Questa sottofamiglia è il ricevitore di acido arginilglycilaspartico, noto anche come RGD o Arg-Gly-Asp.
PS3
Questa sottofamiglia è stata osservata negli invertebrati, in particolare negli insetti. Sebbene si sappia poco, ci sono studi che valutano il loro ruolo essenziale nell'attività funzionale dell'integrina dei leucociti CD11d, nell'uomo.
PS4
Questa sottofamiglia è conosciuta come il gruppo ALFA 4 / ALFA 9 e include subunità con quegli stessi nomi.
Queste subunità sono in grado di abbinare le subunità beta 1 e beta 7. Inoltre, condividono ligandi molto simili alle subunità alfa che presentano alfa I inserito del dominio, come molecole di adesione a cellule vascolari, ligandi nel sangue solubili, fibrinogeno e altri, tra cui persino patogeni.
Può servirti: linfaopoyesis: caratteristiche, fasi, regolamentazioneSubunità beta
Strutturalmente la subunità beta è costituita da una testa, una sezione chiamata gamba / gamba, un dominio transmembrana e una coda citoplasmatica. La testa è composta da un dominio beta I, che viene inserito in un dominio ibrido che si lega al dominio intelleginale di plexine-milefora-integinale, noto anche come PSI.
La sezione STEM / gambe contiene quattro moduli uguali o molto simili al fattore di crescita epidermico dell'integrina ricca di cisteina e, come già accennato, una coda citoplasmatica. Questa coda citoplasmatica, come nella subunità alfa, non ha attività enzimatica o unione Actina.
Hanno catene con una serie di rifiuti compresi tra 760 e 790 e possono unirsi, così come le subunità alfa, i cationi bivalenti.
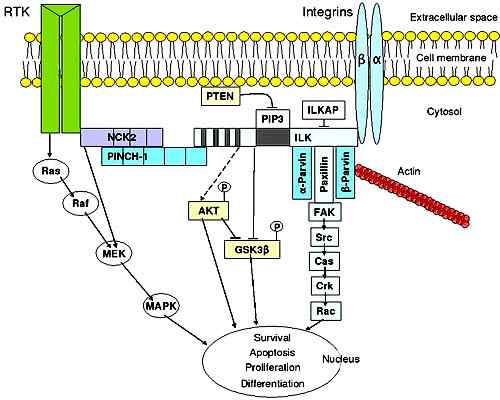 Segnalazione dell'integrina nelle cellule epiteliali. Preso e modificato da K.Murphy in Wikipedia in inglese [dominio di dominio pubblico].
Segnalazione dell'integrina nelle cellule epiteliali. Preso e modificato da K.Murphy in Wikipedia in inglese [dominio di dominio pubblico]. Funzioni
Le integrine hanno molteplici funzioni, tuttavia per le quali sono principalmente conosciute che sono quelle che vedremo di seguito.
Unione o accoppiamento della cellula alla matrice extracellulare
La connessione tra la cellula e la matrice extracellulare grazie alle integrine favorisce la resistenza della cellula alla spinta meccanica, impedendo loro di essere strappati dalla matrice.
Diversi studi suggeriscono che l'accoppiamento alla matrice cellulare è un requisito di base per lo sviluppo di eucarioti multicellulari.
La migrazione cellulare è un processo in cui le integrine intervengono attraverso l'Unione o l'accoppiamento a substrati diversi. Grazie a questo sono coinvolti nella risposta immunitaria e nella guarigione delle ferite.
Trasduzione del segnale dalla matrice extracellulare alla cellula
Integrinas partecipa al processo di trasduzione del segnale. Ciò significa che intervengono nella ricezione di informazioni dal fluido extracellulare, codificano e quindi all'alterazione delle molecole intracellulari, come una risposta.
Questa trasduzione del segnale interviene in un gran numero di processi fisiologici come la distruzione cellulare programmata, la differenziazione cellulare, la meiosi e la miatosi (divisione cellulare) e la crescita cellulare, tra gli altri.
Integrine e cancro
Diversi studi dimostrano che le integrine svolgono un ruolo importante nello sviluppo dei tumori, specialmente nelle metastasi e nell'angiogenesi. Un esempio di ciò sono le integrine αvβ3 e α1β1, tra gli altri.
Può servirti: cellule animaliQueste integrine sono state correlate alla crescita cancerosa, con l'aumento della resistenza terapeutica e delle neoplasie ematopoietiche.
Prospettiva evolutiva
Un'adesione efficiente tra le cellule per formare tessuti era, senza dubbio, una caratteristica cruciale che avrebbe dovuto essere presente nel futuro evolutivo degli organismi multicellulari.
L'emergere della famiglia delle integrine è stata monitorata fino alla comparsa dei metazoos circa 600 milioni di anni fa.
Un gruppo di animali con caratteristiche istologiche ancestrali sono porifere, comunemente chiamati spugne marine. In questi animali, l'adesione cellulare avviene da una matrice extracellulare di proteoglicano. I recettori che si legano a questa matrice hanno un motivo tipico di Integrina Union.
In effetti, in questo gruppo animale, sono stati identificati geni relativi a subunità specifiche di alcune integrine.
Nel corso dell'evoluzione, l'antenato dei Metazoo ha acquisito un integrina e una padronanza dell'Unione a questo che è stata conservata nel tempo in questo immenso gruppo di animali.
Strutturalmente, la massima complessità delle integrine è osservata nel gruppo vertebrato. Esistono diverse integrine che non sono presenti negli invertebrati, con nuovi domini. In effetti, più di 24 diverse integrine funzionali sono state identificate nell'uomo - mentre nella mosca della frutta Drosophila melanogaster Ce ne sono solo 5.
Riferimenti
- Integrina. Clinica dell'Università di Navarra. Recuperato da Cun.È.
- Adesione. Istologia vegetale e animale atlante. Recuperato da Mmegia.siti Web.Uvigo.È.
- B. Alberts, a. Johnson, J. Lewis, et al. (2002). Biologia della cellula molecolare. 4a edizione. New York: Garland Science. Integrine. NCBI recuperato.Nlm.NIH.Gov.
- R.L. Anderson, t.W. Owens e J. Matthew (2014). Funzioni strutturali e meccaniche delle integrine. Recensioni biofisiche.
- Integrina. Recuperato da.Wikipedia.org.
- Cos'è l'integrina? Mbinfo. Recuperato da MechonBio.Informazioni.
- S. Mac Fhearraight & D. Bruce. Il ruolo delle integrine nella segnalazione cellulare. Estratto da Abcam.com.
- A.S. Berghoff, o. Rajky, f. Winkler, r. Bartsch, j. Furtner, j.A Hainfellner, s.L. Goodman, m. Weller, J. Schittenhelm, m. Preusser (2013). Modelli di invasione nelle stasi di porto del cervello dei tumori solidi. Neuro Oncology.
- « Caratteristiche, tipi e selezioni di funzioni
- Caratteristiche di Plumeria Rubra, habitat, usi, parassiti »

