Immunoglobulina M (IgM)
- 2735
- 100
- Lidia Valentini
Cos'è l'immunoglobulina m?
IL immunoglobulina m O IgM È un anticorpo prodotto dalle cellule B o dai linfociti del sistema immunitario di molti animali. Può essere collegato alla membrana plasmatica di queste cellule o può essere secreto sotto forma di un complesso verso il flusso sanguigno e la linfa, quindi partecipa attivamente ai processi di immunità umorale o adattiva.
Così come le altre immunoglobuline (IgG, IgA, IgD e IgE), l'immunoglobulina M ha una struttura in modo tale che lo rende in grado di unirsi a qualsiasi tipo di antigene, tra cui proteine, glicoproteine, polisaccaridi e altri carboidrati altri.
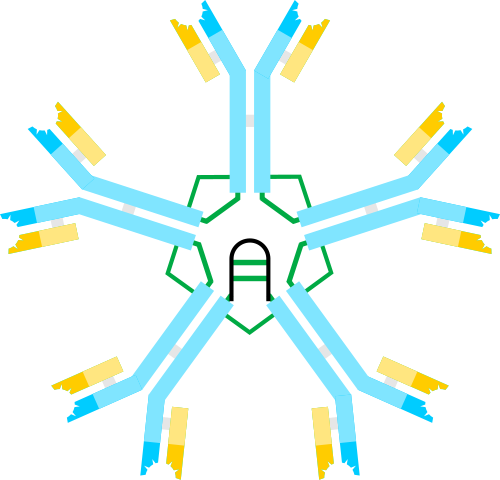
 Schema di immunoglobulina m, un pentmer. Autore: Artur Jan Fijałkowski, Wikimedia Commons
Schema di immunoglobulina m, un pentmer. Autore: Artur Jan Fijałkowski, Wikimedia Commons L'IGM è uno dei primi anticorpi prodotti nel corso di un'infezione batterica e durante lo sviluppo neonatale.
È stato il primo a purificarsi con una significativa omogeneità e poiché è un anticorpo poli reattivo, cioè ha la capacità di unirsi a due o più antigeni contemporaneamente anche se sono diversi in natura, è molto importante per la lotta di diversi Patologie.
Come "anticorpi naturali", cioè quelli che si verificano senza una precedente immunizzazione intenzionale, queste immunoglobuline possono non solo unire gli antigeni batterici, ma anche per virus, protozoi, parassiti metazoari e funghi, nonché alcune componenti del plasma ematico.
Struttura IgM
Analogamente a ciò che è stato descritto per l'immunoglobulina G, uno degli anticorpi più abbondanti nel plasma sanguigno e altre immunoglobuline, i monomeri delle immunoglobuline M hanno una struttura che potrebbe essere descritta come sotto forma di "Y", Plasma come pentamero.
Ognuna delle 5 subunità di questa glicoproteina pentharistica è formata da quattro catene: due identiche catene pesanti "μ" di 55 kDa e due identiche catene di luce di 25 kDa che, se associate alla forma pentamerica solubile, pesano circa 970 kDA.
Può servirti: respirazione della pelle: caratteristiche ed esempi di animaliLe catene di luce sono unite solo a una porzione di catene pesanti grazie alla formazione di ponti disolfuro tra i rifiuti di cisteina.
Quando queste molecole sono idrolizzate enzimaticamente, questa reazione si traduce in due frammenti, uno dei quali "omogeneo", noto come regione costante o FC, e l'altro noto come regione variabile o FAB2 (anche chiamata regione ipervariabile) Un antigene.
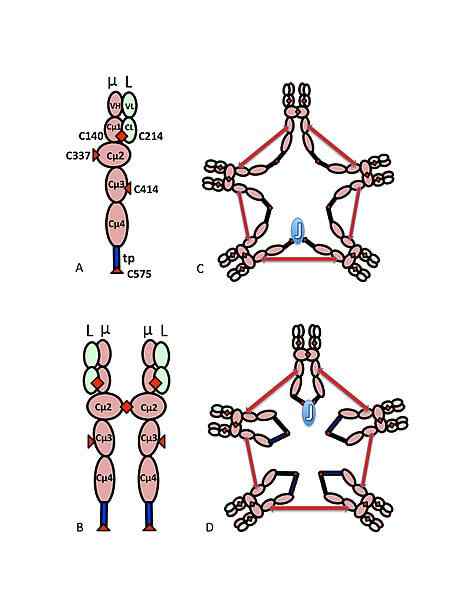 Modello schematico dell'IGM. Fonte: Marc Shulman, CC BY-SA 4.0, via Wikimedia Commons
Modello schematico dell'IGM. Fonte: Marc Shulman, CC BY-SA 4.0, via Wikimedia Commons La sequenza di aminoacidi della pesante catena di immunoglobulina M, in particolare quella della regione costante, è ciò che definisce la sua identità, nonché definisce quella degli altri isotipi di anticorpi che sono stati definiti negli animali, che insieme compongono la superfamiglia delle immunoglobuline.
La struttura terziaria delle catene pesanti e leggere di questo anticorpo è costituita da fogli β-placcati collegati tra loro attraverso legami a lunghezza variabile che possono essere stabilizzati da ponti disolfuro.
Nella forma di pentamérica, ogni monomero IgM interagisce con una catena polipeptidica chiamata catena JDA e che consente la formazione della struttura formata dai 5 monomeri.
Poiché ogni monomero ha la capacità di unirsi a due identiche molecole antigeniche, un pentamero IgM può unirsi a 10 antigeni contemporaneamente.
Funzioni
L'immunoglobulina M partecipa alla risposta iniziale contro gli antigeni batterici, quindi di solito è il primo anticorpo secreto dalle cellule B attivate durante la risposta immunitaria.
Poiché la sua struttura solubile è in grado di unirsi a un gran numero di molecole di antigene, ha la capacità di aggiungere o agglutinare particelle antigeniche appartenenti a cellule come globuli rossi, batteri, protozoi e altri.
Può servirti: gap anionQuesto anticorpo è molto importante per la neutralizzazione precoce delle tossine batteriche ed è anche efficace nella mediazione dell'attività del sistema del complemento, promuovendo la rapida "opsonizzazione" delle particelle antigeniche.
 Rappresentazione grafica dell'immunoglobulina M legata agli epitopi antigenici dei batteri invasivi (Fonte: SA1590 [CC BY-S (https: // creativeCommons.Org/licenze/by-sa/4.0)] via Wikimedia Commons)
Rappresentazione grafica dell'immunoglobulina M legata agli epitopi antigenici dei batteri invasivi (Fonte: SA1590 [CC BY-S (https: // creativeCommons.Org/licenze/by-sa/4.0)] via Wikimedia Commons) La sua forma monomerica è generalmente legata alla membrana plasmatica dei linfociti B "vergini", nonché con l'immunoglobulina D, ed è stato determinato che gran parte del repertorio di cellule B neonati corrisponde ai linfociti con IgM nella sua membrana.
È inoltre necessario evidenziare il fatto che è la prima immunoglobulina prodotta dalle cellule B "vergini" nei feti durante la gravidanza, dopo le prime stimolazioni antigeniche.
Sebbene a bassa concentrazione, l'immunoglobulina M è stata trovata nelle secrezioni degli animali da mammifero, un fatto che suggerisce che partecipa anche alla protezione immunitaria delle mucose mucose del corpo.
Valori elevati (significato) di IGM
Si ritiene che una persona abbia valori elevati di un'immunoglobulina quando gli studi mostrano valori al di sopra dell'intervallo normale.
Alti valori di immunoglobulina masmetica possono essere indicativi della recente esposizione a un antigene, nonché una fase precoce di epatite virale e altre condizioni patologiche come:
- mononucleosi,
- artrite reumatoide,
- Waldestrom macroglobulinemia,
- Sindrome nefrotica (danno renale)
- Sviluppo di infezioni causate da agenti parassiti
Un altro motivo per cui alti valori di IgM possono essere ottenuti nel siero è l'esistenza di sindromi "iper IgM" (HIGM). I pazienti con questa sindrome sono più suscettibili alla sofferenza di infezioni ricorrenti e persino diversi tipi di cancro, poiché impiega un calo drastico dei livelli di IgG.
Può servirti: organi analogici: concetto, evoluzione, caratteristiche ed esempiValori bassi (significato)
L'esistenza di alcune patologie significative come i mielomi multipli, alcuni tipi di leucemia e alcune malattie immunitarie ereditarie sono state correlate a bassi livelli di immunoglobulina M nel siero nel siero.
I pazienti con sindrome da deficit collegati al cromosoma X Wiskott-Aldrich possono avere bassi livelli di IgM, tuttavia, un piccolo aumento dei livelli delle altre quattro immunoglobuline può compensare questa condizione.
Bassi livelli di IgM possono indicare condizioni più gravi come una carenza di immunoglobulina, che possono avere gravi implicazioni per la salute, specialmente durante l'esposizione a nuovi antigeni o nel corso di alcune malattie.
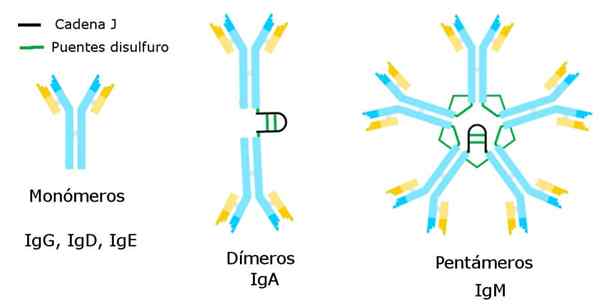 Tipi di immunoglobuline. Fonte: Alejandro Porto, CC BY-SA 3.0, via Wikimedia Commons
Tipi di immunoglobuline. Fonte: Alejandro Porto, CC BY-SA 3.0, via Wikimedia Commons Queste carenze possono avere molte cause, dagli errori nei sistemi di riconoscimento antigenico ai difetti nella produzione di anticorpi da parte dei linfociti B.
Sono stati riportati livelli fino a 40 mg/dL per quei pazienti con carenze selettive delle IgM, che consistono in una forma "rara" di disgammaglobulinemia.
Valori normali
La normale gamma di concentrazione plasmatica di immunoglobulina M è estremamente variabile e dipende, tra molte cose, all'età. Secondo le diverse fasce di età, questo anticorpo è in una concentrazione di:
- 26-122 mg/dl tra 0 e 5 mesi
- 32-132 mg/dl tra 5 e 9 mesi
- 40-143 mg/dl tra 9 e 15 mesi
- 46-152 mg/dl tra 15 e 24 mesi
- 37-184 mg/dl tra 2 e 4 anni
- 27-224 mg/dl tra 4 e 7 anni
- 35-251 mg/dl tra 7 e 10 anni
- 41-255 mg/dl tra 10 e 13 anni
- 45-244 mg/dl tra 13 e 16 anni
- 49-201 mg/dl tra 16 e 18 anni
- 37-286 mg/dl negli adulti di oltre 18 anni, sebbene alcuni testi indicano che l'intervallo è compreso tra 45 e 150 mg/dl, tra 45 e 250 mg/dl o tra 60 e 360 mg/dl
È importante ricordare che questi valori di concentrazione di IgM sono più o meno 10 volte meno di quelli di altre importanti immunoglobuline come IgG, ad esempio.
- « I 18 migliori miti del Messico (divinità e animali)
- 17 problemi ambientali in Messico molto grave »

