indiano

- 3392
- 339
- Baldassarre Ross
 Pezzo indiano metallico. Fonte: immagini ad alta risoluzione degli elementi chimici [CC di (https: // creativeCommons.Org/licenze/di/3.0)]
Pezzo indiano metallico. Fonte: immagini ad alta risoluzione degli elementi chimici [CC di (https: // creativeCommons.Org/licenze/di/3.0)] Cos'è l'indiano?
Lui indiano È un metallo che appartiene al gruppo 13 della tavola periodica e ha un simbolo chimico in. Il tuo numero atomico è 49, 49In, ed è presentato in natura come due isotopi: 113In e 115In, quest'ultimo è il più abbondante. Sulla terra gli atomi indiani si trovano come impurità in zinco e minerali di piombo.
È un metallo particolare, poiché è il più morbido che può essere toccato senza molti rischi per la salute; A differenza del litio e del rubidio, che bruciano terribilmente la pelle quando reagisce con la sua umidità. Un pezzo di indiano può essere tagliato con un coltello e una frattura con la forza delle dita, emettendo uno scricchiolio distintivo.
Chiunque senta questo metallo verrà sicuramente in mente l'India, ma il suo nome deriva dal colore indaco, che si osserva quando viene eseguito il test di fiamma. In questo senso, sembra un bel po 'di potassio, bruciando il suo metallo o i suoi composti con una fiamma molto caratteristica, attraverso la quale l'indiano è stato rilevato per la prima volta nei minerali sfumati.
L'India condivide molte qualità chimiche con alluminio e gallio, presentando nella maggior parte dei composti con un numero di ossidazione di +3 (in3+). Si combina in modo eccellente con le leghe che forma Gallia con bassi punti di fusione, uno dei quali è il Galinstan.
Le applicazioni indiane si basano sul rivestimento dei materiali con le loro leghe, rendendoli conduttori elettrici e flessibili. L'indiano ha un po 'di vetro per concedere loro più luccicanti, sostituendo l'argento. Nel mondo della tecnologia, l'indiano si trova sui touch screen e sugli LCD.
Scoperta
Nel 1863, il chimico tedesco Ferdinand Reich era alla ricerca di tracce dell'elemento Talio, usando la linea verde del suo spettro di emissione, in minerali di Cinc; In particolare campioni di sfalerite (ZN) intorno alla Sassonia. Dopo aver tostato i minerali, rimuovere il contenuto di zolfo, digerirli in acido cloridrico e distillare il cloruro di zinco, ottenere un precipitato di pajizo.
Data la scoperta, Reich ha deciso di eseguire un'analisi spettroscopica; Ma poiché non aveva degli occhi buoni per osservare i colori, andò dal suo collega Hariomus Theodor Richter per aiutarlo in questo compito. Richter è stato quello che ha osservato una linea spettrale bluastra, che non corrispondeva allo spettro di nessun altro elemento.
Può servirti: acido iodosio (Hio2): proprietà e usiI due chimici tedeschi stavano affrontando un nuovo elemento, che era chiamato colore indiano per il colore indaco della fiamma quando i loro composti bruciavano; E a sua volta, il nome di questo colore deriva dalla parola latina Indicum, Cosa significa l'India.
Un anno dopo, nel 1864, eccitato e dopo una serie prolungata di precipitazioni e purificazioni, isolarono un campione di indiano metallico attraverso l'elettrolisi dei loro sali disciolti in acqua.
Struttura indiana
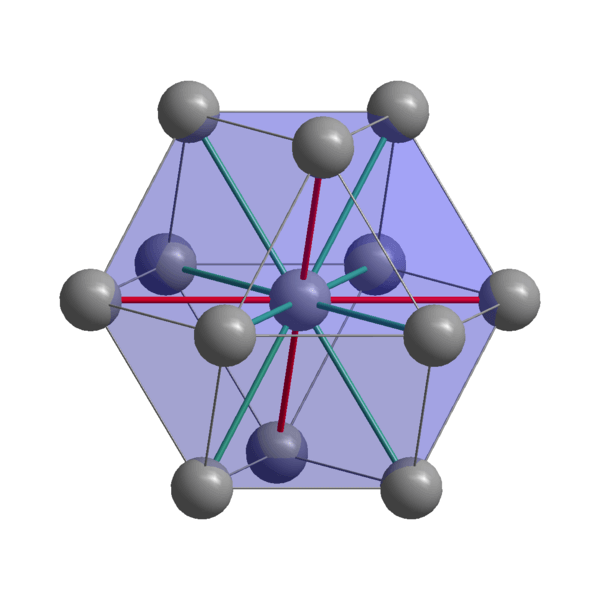 Struttura cristallina indiana
Struttura cristallina indiana Indiani, in atomi di coesione usando i loro elettroni di valenza per stabilire un legame metallico. Pertanto, finiscono per essere ordinati in una struttura tetragonale distorta centrata sul corpo. Le interazioni tra gli atomi in-in-in-in-berborano sono relativamente deboli, il che spiega perché l'indiano ha un punto di fusione basso (156 ºC).
D'altra parte, le forze che uniscono due o più cristalli indiani non sono forti, altrimenti non si muovevano l'una sull'altra, conferendo la morbidezza caratteristica del metallo.
Proprietà indiane
Aspetto fisico
È un metallo argento straordinariamente morbido. Può strappare con la pressione dell'unghia, tagliare con un coltello o graffiare con tratti luminosi su un foglio di carta. È persino possibile masticarlo e deformarlo con i denti, a condizione che sia appiattito. È anche molto duttile e malleabile, con proprietà di plastica.
Quando l'indiano riscaldato con una torcia licenzia una fiamma di un colore indaco, anche più luminoso e più colorato di quello del potassio.
Massa molare
114,81 g/mol
Punto di fusione
156.60 ºC
Punto di ebollizione
2072 ºC.
Come la Gallia, l'indiano ha un grande intervallo di temperatura tra il suo punto di fusione e l'ebollizione. Ciò riflette il fatto che le interazioni in-in nel liquido sono più forti di quelle che predominano nel vetro; E quindi, è più facile ottenere una goccia di indiano rispetto ai loro vapori.
 Posizione indiana nella tavola periodica. Fonte: Daniel Mayer o GreatPatton Vectorization: Sushant Savla, CC BY-SA 3.0, via Wikimedia Commons
Posizione indiana nella tavola periodica. Fonte: Daniel Mayer o GreatPatton Vectorization: Sushant Savla, CC BY-SA 3.0, via Wikimedia Commons Densità
A temperatura ambiente: 7,31 g/cm3
Proprio al punto di fusione: 7,02 g/cm3
Elettronegatività
1.78 sulla scala Pauling
Energie di ionizzazione
Primo: 558,3 kj/mol
Secondo: 1820,7 kJ/mol
Terzo: 2704 kJ/mol
Conduttività termica
81,8 W/(M · K)
Resistività elettrica
83,7 nω · m
Durezza MOHS
1.2. È appena un po 'più difficile del talco (non confuso con duro).
Reattività
L'indiano si dissolve in acidi per causare sali, ma non si dissolve in soluzioni alcaline, anche con idrossido di potassio caldo. Reagisce a diretto contatto con zolfo, ossigeno e alogeni.
Può servirti: diluizione: concetto, come è fatto, esempi, eserciziL'indiano è relativamente anfoterico, ma si comporta più come base che come acido, essendo le sue soluzioni acquose leggermente di base. Il in (oh)3 È redisolpe con l'aggiunta di più alcali che causano complessi indiani, in (OH)4-, come con gli alluminati.
Configurazione elettronica
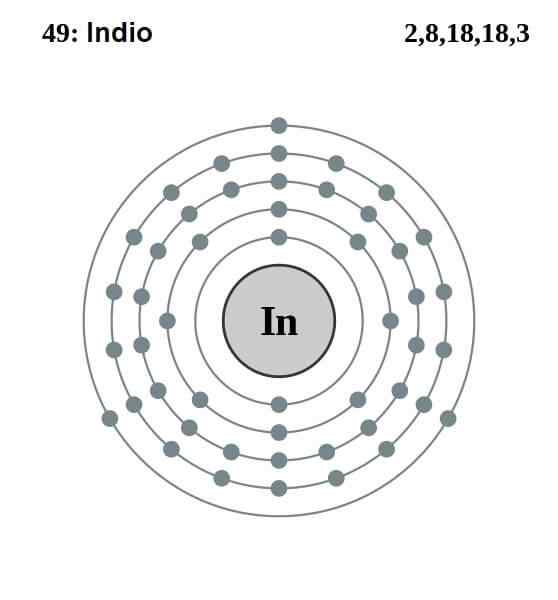 Configurazione indiana elettronica
Configurazione indiana elettronica La configurazione elettronica dell'indiano è la seguente:
[Kr] 4D10 5s2 5 p1
Di quei tredici elettroni, gli ultimi tre degli orbitali 5S e 5p sono quelli di Valencia. Con questi tre elettroni gli atomi indiani stabiliscono il loro legame metallico, come fanno l'alluminio e il gallio e formano legami covalenti con altri atomi.
Numeri di ossidazione
Quanto sopra è usato per stare immediatamente che l'indiano è in grado di perdere i suoi tre elettroni di Valencia o vincere cinque per diventare isolectronic a nobile xeno.
Se in un composto supponiamo che abbia perso i suoi tre elettroni, rimarrà come il catione trivalente3+ (In analogia Al3+ e ga3+) e, quindi, il numero di ossidazione sarà +3. La maggior parte dei composti indiani sono in (iii).
Tra gli altri numeri di ossidazione trovati per gli indiani che abbiamo: -5 (in5-), -2 (in2-), -1 (in-), +1 (in+) e +2 (in2+).
Alcuni esempi di composti in (i) sono: inf, incl, inbr, ini e in2O. Tutti sono composti relativamente rari, mentre quelli di in (iii) sono i predominanti: in (OH)3, In2O3, Incl3, Inf3, eccetera.
In (i) i composti sono potenti agenti riducenti, in cui in+ Dona due elettroni ad altre specie in cui entrare3+.
Isotopi
L'indiano è presentato in natura come due isotopi: 113In e 115In, le cui abbondanze di terra sono rispettivamente del 4,28% e del 95,72%. Pertanto, sulla Terra abbiamo molti più atomi di 115In quello di 113In. Lui 115In ha una mezza vita di 4,41 · 1014 anni, così grande che è praticamente considerato stabile, nonostante sia un radioisotopo.
Al momento, sono stati creati un totale di 37 isotopi artificiali di indiani, tutti radioattivi e molto instabili. Di tutti loro, il più stabile è il 111In, che ha una mezza vita di 2,8 giorni.
Usi/applicazioni
Leghe
L'indiano va molto bene con il gallio. Entrambi i metalli formano leghe che mel. Inoltre, l'indiano è anche facilmente amalgamous, con una solubilità del 57% a Mercurio.
Può servirti: acido acetico (ch3cooh)Le leghe indiane vengono utilizzate per progettare specchi d'argento senza ricorrere all'argento. Quando vengono versati su un'area di qualsiasi materiale, funge da aderente, in modo che possano essere raccolti vetro, metallo, quarzo e ceramica.
elettronica
 Senza l'indiano i touch screen non sarebbero mai esistiti
Senza l'indiano i touch screen non sarebbero mai esistiti L'indiano va anche d'accordo con Germanio, quindi i suoi composti vengono aggiunti come doping al nitruro germanico dei LED, riproducendo queste miscele blu luci, viola e verde. Fa anche parte dei transistor, dei termistori e delle celle fotovoltaiche.
Il più importante dei suoi composti è la stagno e l'ossido indiano, che viene usato come fodera di vetro per riflettere alcune lunghezze d'onda. Ciò ti consente di essere utilizzato negli occhiali da saldatura e nel vetro graffiato in modo che non si riscaldano.
Il vetro rivestito con questo ossido è buoni conduttori di elettricità; Come quello dalle nostre dita. Ed è per questo che è destinato alla produzione di touch screen, anche più attività attuali a causa dell'emergere di sempre più smartphone.
Rischi
 Indiano a stato solido. Fonte: w. Oelen, CC BY-SA 3.0, via Wikimedia Commons
Indiano a stato solido. Fonte: w. Oelen, CC BY-SA 3.0, via Wikimedia Commons L'indiano non rappresenta alcun rischio per l'ambiente in primo luogo, come negli ioni in3+ Non sono diffusi in quantità apprezzabili. Non ci sono informazioni su quale sarebbe il suo impatto sui suoli, che colpisce le piante e né nella fauna né in mare.
Nel corpo non è noto se gli ioni in3+ Hanno una certa partecipazione essenziale al metabolismo in tracce. Tuttavia, quando i loro composti vengono ingeriti, sono dannosi per diversi organi, motivo per cui sono considerati sostanze altamente tossiche.
In effetti, le particelle ITO (stagno e ossido indiano, per il suo acronimo in inglese: Ossido di stagno di indio), indispensabile per la produzione di schermi per computer e smartphone, possono avere un impatto negativo sulla salute dei lavoratori, causando loro una malattia chiamata polmoni indiani.
L'assunzione di queste particelle si verifica soprattutto per inalazione e per contatto attraverso la pelle e gli occhi.
D'altra parte, le particelle indiane metalliche sottili sono inclini a bruciare e causare incendi se sono recinzioni una fonte di calore.

