Importanza della tabella periodica 8 motivi
- 4088
- 173
- Lidia Valentini
IL Importanza della tavola periodica È innegabile per il semplice fatto che per più di cento anni ha sostenuto gli scienziati di ordinare tutti gli elementi chimici e continuerà a farlo per il resto dell'esistenza umana. È una sorta di edificio con basi sperimentali e teoriche che riassume le proprietà della materia nota.
Sebbene siano stati sviluppati diversi modelli prima della tavola periodica del chimico russo Dmitri Mendeleev, lo scopo è sempre stato lo stesso: ordine, individuare e prevedere elementi chimici che condividono le proprietà in comune. Pertanto, le posizioni o le scatole di questa tabella rivelano più informazioni di quelle che possono essere intervistate ad occhio nudo.
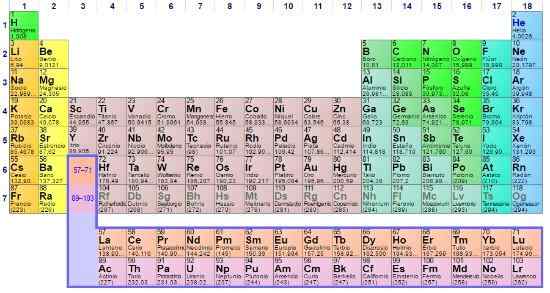
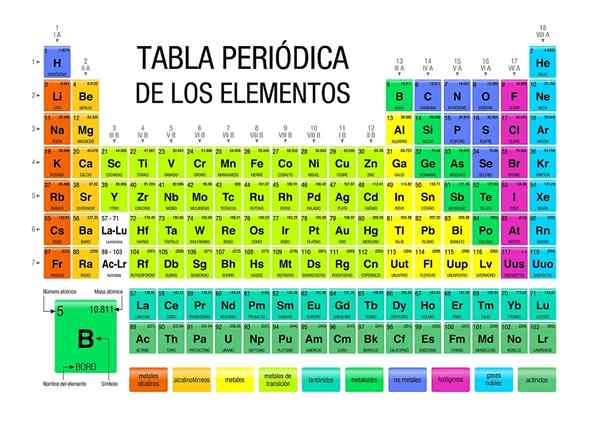 La tabella periodica è un icona e uno strumento scientifico in cui chimica, fisica, storia e letteratura convergono
La tabella periodica è un icona e uno strumento scientifico in cui chimica, fisica, storia e letteratura convergono La tavola periodica è presente a tutti i livelli di formazione accademica, essendo persino un'icona di conoscenza generale. Sebbene sia essenziale in chimica, la verità è che è importante anche per la fisica e la biologia, oltre ad essere fonte di studio e ispirazione per gli amanti della storia e della letteratura.
Ecco perché alcuni dei motivi per cui la tabella periodica è importante.
Qual è l'importanza della tavola periodica?
Puoi dare diversi motivi che spiegano l'importanza di questo strumento scientifico:
È la base della chimica inorganica

La chimica inorganica è praticamente lo studio della tavola periodica. Senza di essa, tutte le conoscenze raggiunte attorno a questo tipo di materia sarebbero diminuite. Coloro che sono dedicati a questo ramo di chimica, è essenziale che possano leggere ed estrarre tutte le informazioni che questa tabella offre sugli elementi chimici oltre il carbonio e i suoi isotopi.
Per le sostanze chimiche organiche, molte volte dai un'occhiata sul lato destro della tavola periodica: più precisamente verso la parte superiore del blocco P, dove si trova il carbonio e diversi non metallici.
Può servirti: tritioD'altra parte, i chimici inorganici devono rivedere tutti i metalli che compongono i blocchi D E F, Oltre al gruppo 18 di gas nobili, quindi finiscono per familiarizzare con tutti gli elementi chimici; Tranne forse quelli che sono sintetici e altamente radioattivi.
Far luce sulla conoscenza chimica
Prima della tavola periodica e dei primi tentativi di ordinare gli elementi chimici in base alle sue somiglianze, la chimica era avvolta in un'aura e misticismi incerti.
Nessuno sapeva esattamente quanti o quali fossero tutti gli elementi chimici che potevano esistere in natura. Grazie a questo tavolo oggi è noto che abbiamo un massimo di 118 elementi. Ciò che sembrava oscuro prima, ora è chiaro, comprensibile e organizzato.
Consente di prevedere le proprietà di nuovi elementi
All'inizio, la tavola periodica conteneva spazi vuoti, perché a quel punto non erano stati scoperti molti elementi chimici.
Le posizioni di questi spazi indicavano che il nuovo elemento, secondo i suoi coetanei, doveva reagire in modo simile; E ancora di più, potrebbe anche essere trovato nelle stesse fonti minerali.
Ed era in effetti nel trattamento chimico delle sinfine minerali in cui venivano scoperti lentamente gli elementi chimici mancanti; Ad esempio, Gallio, Germanio e Scandio. Il gallio, essere sotto alluminio, ha dovuto condividere le proprietà con quest'ultimo e formare minerali (ossidi, solfuri, cloruri, ecc.) lo stesso tipo.
Se fosse stato creato l'elemento 119, dovrebbe necessariamente trovarsi sotto Francesco, nel gruppo 1; e quindi, reagire o avere proprietà chimiche simili a quelle degli altri metalli alcalini (litio, sodio, potassio, ecc.).
Può servirti: fattore di diluizioneDifferenza e classificare gli elementi chimici
Nella tabella periodica è possibile osservare come gli elementi sono classificati e disponibili in aree o gruppi specifici. Ad esempio, i non metalli sono orientati verso la parte superiore destra.
Nel frattempo, i metalli, che costituiscono la maggior parte degli elementi, integrano il lato sinistro e il centro del tavolo, nonché il blocco F: Quelle due file di seguito.
Ogni gruppo elencato da 1 a 18, definisce una famiglia di elementi. Quelli del gruppo 1 sono chiamati metalli alcalini, quelli del gruppo 2, metalli alcalinotherro, quelli del 3, gruppo dello scandio e così via. Alcuni gruppi hanno nomi univoci, come il gruppo 16 o l'ossigeno, che si chiama calcogens o anfumo.
Memorizzare enormi quantità di informazioni
Nelle tabelle periodiche possiamo vedere i numeri di ossidazione per ciascun elemento, le loro energie di ionizzazione, la sua massa atomica media, le sue configurazioni elettroniche, le sue elettronegatività e l'intero insieme delle sue proprietà periodiche.
Inoltre, in alcune tabelle è persino possibile trovare informazioni sulla sua normale fusione e punti di ebollizione, nonché sulle strutture cristalline dei suoi solidi. In questo senso, compaiono tavoli periodiche più specializzate rispetto ad altre, a seconda del lavoro e del livello accademico.
Chiarisce le tendenze periodiche
Seguendo i gruppi e i ranghi della tabella periodica, è possibile osservare chiaramente come le proprietà periodiche stanno cambiando mentre passiamo da un elemento a un altro.
Ad esempio, il raggio atomico diminuisce per tutta la riga, da sinistra a destra, ma aumenta quando scendiamo da un gruppo. Inoltre, il carattere metallico aumenta dall'alto verso il basso e da destra a sinistra.
Prevede la natura dei composti che si formano
I composti si formano quando due o più elementi reagiscono tra loro. A seconda delle rispettive posizioni nella tavola periodica, è possibile prevedere quale sarà la natura chimica di questo composto in questione.
Può servirti: bromuro di idrogeno (HBR)Ad esempio, se reagiscono il sodio metallico e il cloro a gas, darà origine al cloruro di sodio, un sale. Questo perché il sodio è un metallo, mentre il cloro non metale, le cui differenze tra le sue elettronegatività sono grandi, favoriscando così la formazione di un composto ionico.
È una finestra della storia della scienza
 Marie Curie
Marie Curie Ogni elemento ha la sua storia e gli scopri. I loro semplici nomi sono riflessi o quelli che li hanno scoperti, dalle regioni geografiche in cui sono stati estratti nelle loro forme pure o nel colore caratteristico dei loro minerali. Ad esempio, il gas elio deve il suo nome proprio perché è stato identificato al sole.
Nel tavolo periodico vediamo un pezzo della vita di Antoine Lavoisier, Marie Curie, Carl Willhelm Scheele, Henry Cavendish, Paul Emile Lecog e molti altri scienziati che hanno contribuito a completare il tavolo quando hanno scoperto nuovi elementi chimici.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Helmestine, Anne Marie, PH.D. (11 febbraio 2020). Perché la tabella del periodo è importante? Recuperato da: Thoughtco.com
- Ben p. Stein. (28 maggio 2019). La tabella periodica: è molto più di una semplice chimica e fisica. Recuperato da: NIST.Gov
- Dennis Rouvray. (10 gennaio 2019). La tabella del periodo è stata il passaggio più importante della chimica. New Scientist Ltd. Recuperato da: Newscientist.com
- Wanda Thibodeaux. (26 aprile 2018). L'importanza di una tavola periodica. Recuperato da: scientifici.com
- « Concetto, caratteristiche ed esempi di oggetti opachi
- Concetto, caratteristiche ed esempi di Live Matter »

