Holmio

- 1541
- 42
- Kayla Serr
 Campione metallico holm ultrapure. Fonte: immagini ad alta risoluzione degli elementi chimici [CC di 3.0 (https: // creativeCommons.Org/licenze/di/3.0)]
Campione metallico holm ultrapure. Fonte: immagini ad alta risoluzione degli elementi chimici [CC di 3.0 (https: // creativeCommons.Org/licenze/di/3.0)] Cos'è Holmio?
Lui Holmio È un elemento metallico appartenente al blocco F della tavola periodica, in particolare al periodo dei Lantanidi. È quindi un membro delle Rare Earths, accanto a Erbio, itrio, disposizione e iterbio. Tutti questi costituiscono una serie di minerali (Xenotima o Gadolinita) che sono difficili da separare attraverso metodi chimici convenzionali.
Il suo simbolo chimico è l'HO, con un numero atomico di 67, ed essendo meno abbondante della disposizione dei suoi vicini (66Dy) ed erbio (68Er). Si dice quindi che la regola Oddo-Harkins obbedisce. Holmius è uno di quei rari metalli che quasi nessuno conosce o sospetta la sua esistenza; Anche tra i prodotti chimici, di solito non viene menzionato molto frequentemente.
Nelle aree della medicina, Holmio è noto per l'uso del suo laser negli interventi chirurgici per combattere le patologie della prostata. Rappresenta anche il materiale promettente per la produzione di elettromagneti e computer quantistici, a causa delle sue insolite proprietà magnetiche.
Composti di olmio, trivalente, ho3+, Presentano la peculiarità di esibire un colore dipendente dalla luce con cui sono irradie. Se questo è fluorescente, il colore di questi composti cambia da giallo al rosa. Allo stesso modo, succede con le sue soluzioni.
Storia
La scoperta di Holmio è attribuita a due sostanze chimiche svizzere, Marc Defontaine e Jacques-Louis Soret, che nel 1878 fu rilevato spettroscopicamente mentre si analizzava nei minerali di Ginevra delle terre rare. Lo chiamavano elemento x.
Solo un anno dopo, nel 1879, il chimico svedese per Teodor Cleve2O3). Questo ossido, contaminato da altre impurità, ha mostrato una colorazione marrone, che ha chiamato "Holmia", che significa ictus in latino.
Può servirti: reazione esergonica: caratteristiche ed esempiInoltre, Cleve ottenne un altro materiale verde: "Thulia", che diventa ossido di tulio. Il problema di questa scoperta è che nessuna delle tre sostanze chimiche poteva ottenere un campione sufficiente puro dell'ossido di holm, poiché era contaminato da atomi di Dodch, un altro metallo lantanide.
Non era altro che nel 1886 che la sostanza chimica francese, Paul Lecoq di Boisbaudran, isolasse l'ossido di holm mediante precipitazione frazionata. Questo ossido successivamente subì reazioni chimiche per produrre sali di holmio, che furono ridotti nel 1911 dal chimico svedese Otto Holmberg; E così, sono apparsi i primi campioni di holm metallici.
Tuttavia, attualmente gli ioni di Holmio, Hol3+, Sono estratti mediante cromatografia a scambio ionico, invece di ricorrere alle reazioni convenzionali.
Proprietà Holm
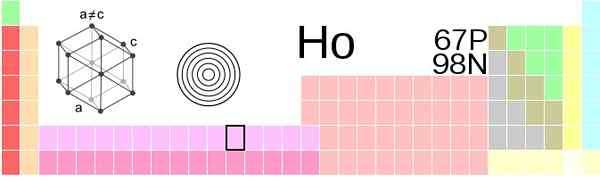 Posizione di Holmio nella tavola periodica. Fonte: Vectorization: Sushant Savla 05:51, 9 giugno 2019 (UTC), CC BY-SA 4.0, via Wikimedia Commons
Posizione di Holmio nella tavola periodica. Fonte: Vectorization: Sushant Savla 05:51, 9 giugno 2019 (UTC), CC BY-SA 4.0, via Wikimedia Commons Aspetto fisico
Metal argento, morbido, duttile e malleabile.
Numero atomico
67 (67Ho)
Massa molare
164,93 g/mol
Punto di fusione
1461 ºC
Punto di ebollizione
2600 ºC
Densità
A temperatura ambiente: 8,79 g/cm3
Proprio quando si scioglie o si scioglie: 8,34 g/cm3
Calore di fusione
17 kj/mol
Calore di vaporizzazione
251 kJ/mol
Capacità termica molare
27.15 J/(mol · K)
Elettronegatività
1.23 sulla scala Pauling
Energie di ionizzazione
Primo: 581,0 kJ/mol (Ho+ gassoso)
Secondo: 1140 kJ/mol (Ho2+ gassoso)
Terzo: 2204 kJ/mol (Ho3+ gassoso)
Conduttività termica
16.2 W/(M · K)
Resistività elettrica
814 nω · m
Numeri di ossidazione
L'Holm può essere presentato nei suoi composti con i seguenti numeri o stati di ossidazione: 0, +1 (Ho+), +2 (Ho2+) e +3 (Ho3+). Di tutti loro, +3 è di gran lunga il più comune e stabile. Pertanto, l'holm è un metallo trivalente, che forma composti (ionici o parzialmente ionici) dove partecipa come ho ione3+.
Può servirti: acetato di etileAd esempio, nei seguenti composti l'Holm si trova con +3 Numero di ossidazione: Ho2O3 (Ho23+O32-), Ho (oh)3, HOI3 (Ho3+Yo3-) e ho2(SW4)3.
L'Ho3+ E le sue transizioni elettroniche sono responsabili dei composti di questo aspetto metallico giallo marrone. Tuttavia, quando si irradiano con luce fluorescente, diventano rosa. Lo stesso vale per le loro soluzioni.
Isotopi
Holmio è presentato in natura come un singolo isotopo stabile: 165Ho (abbondanza al 100%). Tuttavia, ci sono radioisotopi artificiali con notevoli momenti di mezza vita. Tra loro abbiamo:
-163Ho ((T1/2 = 4570 anni)
-164Ho ((T1/2 = 29 minuti)
-166Ho ((T1/2 = 26.763 ore)
-167Ho ((T1/2 = 3,1 ore)
Ordine magnetico e momento
L'holm è un metallo paramagnetico, ma può diventare ferromagnetico a una temperatura di 19 K, esibendo proprietà magnetiche molto forti. È caratterizzato dall'avere il momento magnetico (10,6 μB) più grande tra tutti gli elementi chimici, nonché una permeabilità magnetica insolita.
Reattività
L'holm è un metallo che in condizioni normali non si osserva troppo velocemente, quindi ci vuole per perdere la sua luminosità. Tuttavia, quando viene riscaldato con un accendino diventa giallastro, il prodotto della formazione di uno strato di ossido:
4 ho + 3 o2 → 2 Ho2O3
Reagisce con acidi diluiti o concentrati per causare i rispettivi sali (nitrati, solfati, ecc.). Tuttavia e sorprendentemente, non reagisce con l'acido fluororico, poiché uno strato HOF3 protegge dal suo degrado.
L'Holmio reagisce anche con tutti gli alogeni per produrre i rispettivi alogenuri (HOF3, Hocl3, Hobr3 e Hoi3).
Struttura chimica
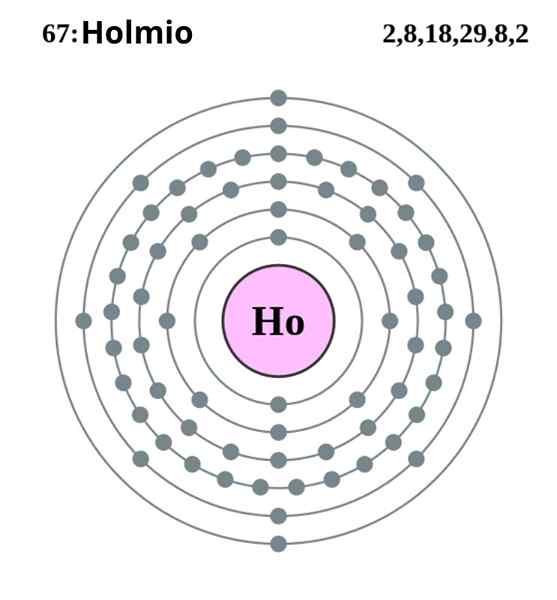 Configurazione elettronica Holmio. Fonte: Pumba (lavoro originale di Greg Robson) Creative Commons Recognition-Share con la stessa licenza 2.0 Inghilterra e paese del Galles
Configurazione elettronica Holmio. Fonte: Pumba (lavoro originale di Greg Robson) Creative Commons Recognition-Share con la stessa licenza 2.0 Inghilterra e paese del Galles L'Holmio si cristallizza in una struttura esagonale compatta, HCP (per il suo acronimo in inglese: esagonale raggruppato). In teoria, gli atomi di HO rimangono coesi grazie al legame metallico formato dagli elettroni dei loro orbitali 4F, secondo la loro configurazione elettronica:
Può servirti: diluizione: concetto, come è fatto, esempi, esercizi[Xe] 4fundici 6s2
Tali interazioni, così come il sistema energetico dei suoi elettroni, definiscono le proprietà fisiche di Holmio. Questo metallo non è noto nessun altro alotropo o polimorfo, nemmeno sotto le alte pressioni.
Applicazioni
Reazioni nucleari
L'atomo di Holmio è un buon neutrone assorbente, quindi aiuta a controllare lo sviluppo delle reazioni nucleari.
Spettroscopia
Le soluzioni di ossido di Holmio sono usate per calibrare gli spettrofotometri, poiché il loro spettro di assorbimento rimane quasi sempre, indipendentemente dalle impurità che contiene. Mostra anche bande acute molto caratteristiche associate all'atomo di Holmio e non ai suoi composti.
Colorante
Gli atomi di Holmio sono in grado di fornire colorazioni rossastre al vetro e alle gemme artificiali di circuiti cubici.
Magneti
A temperature estremamente basse (30 K o meno), Holmius mostra interessanti proprietà magnetiche, che vengono utilizzate per produrre potenti elettromi, dove aiuta a concentrare il campo magnetico risultante.
Tali materiali magnetici sono destinati alla risonanza magnetica nucleare; per lo sviluppo di dischi rigidi, con ricordi che oscillano nell'ordine dei petabyte o dei terabyte; e per produrre eventuali computer quantistici.
Holmio Laser
Un cristallo di granato ititrio-alluminio (YAG) può essere doping con gli atomi di Holmio per emettere una radiazione la cui lunghezza d'onda è di 2 μm; Cioè, abbiamo un laser Holm. Grazie a lui, il tessuto tumorale può essere tagliato proprio senza causare sanguinamento, poiché l'energia ha fornito immediatamente le ferite.
Questo laser è stato usato in modo ricorrente negli interventi di prostata e dentale, nonché per eliminare le cellule tumorali e le calcoli renali.

