Struttura di idrossido di nichel (III), proprietà, usi, rischi
- 4593
- 862
- Benedetta Rinaldi
Lui Idrossido di nichel (III) È un composto inorganico in cui il metallo di nichel ha un numero di ossidazione di 3+. La sua formula chimica è Ni (OH)3. Secondo le fonti consultate, finora non è stato possibile verificare l'esistenza di idrossido di nichel (III) o (OH)3, Ma è stato ottenuto il nichel oxo-idrossido (III), figlio (OH).
Il nichel (iii) nio (OH) oxoidrossido è un solido cristallino nero che si cristallizza in due modi: la forma beta e gamma. La forma cristallina più comune (OH) è beta.
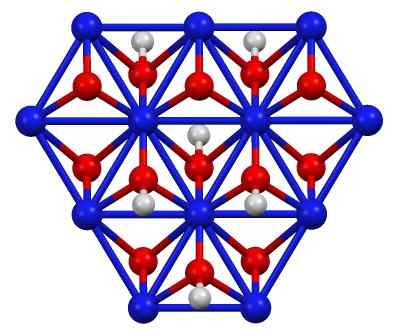
 Struttura di oxoidrossido di nichel (III), bambino (OH). Blu = nichel, rosso = ossigeno, bianco = idrogeno. Autore: Smokefoot. Fonte: proprio lavoro. Fonte: Wikipedia Commons
Struttura di oxoidrossido di nichel (III), bambino (OH). Blu = nichel, rosso = ossigeno, bianco = idrogeno. Autore: Smokefoot. Fonte: proprio lavoro. Fonte: Wikipedia Commons Il bambino (OH) può essere ottenuto mediante ossidazione di soluzioni di nitrati di nichel (II) (o (no3)2) con cloro (CL2) o bromo (br2) In presenza di idrossido di potassio (KOH). Il nichel (iii) oxoidrossido è molto solubile in acidi. Ha applicazione nelle batterie in nichel, in Superca.
Nichel (iii) nio (OH) e idrossido di nichel (II) o (OH) (OH)2 Sono uniti nel funzionamento della maggior parte delle loro applicazioni, poiché entrambe fanno parte della stessa equazione di riduzione dell'ossido.
Essendo un composto di nichel, il bambino (OH) presenta gli stessi rischi di altri sali di nichel, cioè irritazione cutanea o dermatite e cancro.
[TOC]
Struttura cristallina
Nichel oxoidrossido (III) si cristallizza in due modi: beta e gamma. La forma beta β-NIO (OH) ha una struttura molto simile a β-NI (OH)2, che sembra logico perché il primo deriva dall'ossidazione di quest'ultimo.
La forma gamma γ-NIO (OH) è il prodotto di ossidazione dell'idrossido di nichel (II) nella sua forma alfa, α-Ni (OH)2. Come quest'ultimo, Gamma ha una struttura a strati con ioni metallici alcalini, anioni e acqua intervallati tra gli strati.
Configurazione elettronica
Nel bambino (OH) il nichel si trova nello stato di ossidazione 3+, il che significa che mancano 3 elettroni ai suoi strati più esterni, cioè due elettroni di strato 4 mancanoS e un elettrone dallo strato 3D. La configurazione elettronica di NI3+ Nel bambino (oh) è: [ar] 3D7, Dove [AR] è la configurazione elettronica del gas di argon nobile.
Può servirti: PI LinkNomenclatura
- NIO (OH): nichel oxoidrossido (III)
- Nickel Black
Proprietà
Stato fisico
Solido cristallino nero.
Solubilità
Il nio (OH) l'ossoidrossido è molto solubile in acidi. La fase gamma si dissolve in acido solforico con evoluzione dell'ossigeno.
Altre proprietà
In acqua calda diventa un oxoidrossido di nichel (II) e (iii), o3O2(OH)4.
Si decompone a 140 ºC in nichel (II) (ossido di ossigeno e ossigeno.
La fase gamma (γ-NIO (OH)) può essere ottenuta in diversi modi, ad esempio, trattando il nichel con una miscela fusa di perossido di sodio (NA2O2) e idrossido di sodio (NaOH) a 600 ºC e raffreddamento in acqua ghiacciata.
La fase gamma si rompe quando riscaldata a 138 ºC.
Applicazioni
Nelle batterie di nichel
La batteria di nichel-idrum di Edison, in cui KOH viene utilizzata come elettrolita, si basa sulla reazione di oxoidrossido di nichel (III) con ferro:
Scaricamento:
Fe + 2NIO (OH) + H2O ⇔ Faith (Oh)2 + 2NI (OH)2
Fardello:
È una reazione reversibile di riduzione dell'ossido.
Nell'anodo di queste batterie si verifica una serie di processi chimici ed elettrochimici. Di seguito è riportato uno schema generale:
Scaricamento
β-ni (OH)2 ⇔ β-NIO (OH) + H+ + E-
Fardello
Invecchiamento ↑ ↓ sovraccarico
Scaricamento
α-Ni (OH)2 ⇔ γ-NIO (OH) + H+ + E-
Fardello
Può servirti: arsenico: storia, struttura, proprietà, usiNella tecnologia della batteria al nichel, il nichel oxohydrossido (III) NIO (OH) è chiamato "massa attivo nichel".
 Batterie ricaricabili in nichel. Autore: Superusergeneric. Fonte: proprio lavoro. Fonte: Wikipedia Commons.
Batterie ricaricabili in nichel. Autore: Superusergeneric. Fonte: proprio lavoro. Fonte: Wikipedia Commons. Nell'elettrocatalisi come catalizzatore rigenerante
Il bambino (OH) è stato usato con successo nell'elettrosintesi degli azopirazoli, attraverso l'ossidazione elettrocatalitica degli aminopirazoli. La sua utilità nella sintesi di acidi carbossilici a partire da alcoli o composti carbonilici è stata anche dimostrata.
 Ottenere un acido carbossilico ossidando un alcol catalizzato dal bambino (OH). Fonte: originaria di In.Wikipedia. Il caricatore dell'autore originale era v8rik in in.Wikipedia. Fonte: Wikipedia Commons
Ottenere un acido carbossilico ossidando un alcol catalizzato dal bambino (OH). Fonte: originaria di In.Wikipedia. Il caricatore dell'autore originale era v8rik in in.Wikipedia. Fonte: Wikipedia Commons Un altro esempio è quello della conversione quantitativa dell'idrossimetipiridina in acido piridocarbossilico. In questo caso, l'elettrodo in acciaio o nichel corrispondente all'anodo è coperto da uno strato di figlio (OH). Il mezzo in cui viene eseguita l'elettrolisi è alcalino.
In queste reazioni, il bambino (OH) funge da mediatore di outdoor a riduzione o mediatore "redox".
L'elettrolisi viene eseguita in una cella con anodo nichel e catodo in titanio, in mezzo alcalino. Durante il processo è formato o (OH)2 Sulla superficie dell'anodo del nichel, che viene rapidamente ossidato in bambino (OH):
Ni (oh)2 + OH- - E- ⇔ nio (OH) + H2O
Il bambino (OH) reagisce con il substrato organico e si ottiene il prodotto organico desiderato, rigenerando il NI (OH)2:
Nio (OH) + composto organico → ni (OH)2 + Prodotto
Quando il Ni (OH) si rigenera2, La reazione di catalisi continua.
L'uso del bambino (OH) come elettrocatizzatore consente di ottenere composti organici a basso costo e in modo ecologico.
In super card pisors
Il bambino (oh) insieme a Ni (oh)2 Costituiscono materiali eccellenti per l'elettrodi supercaiding (inglese Supercapacitos).
Ni (oh)2 + OH- ⇔ nio (OH) + H2O + e-
Hanno elevato capacità, basso costo e, secondo alcuni riferimenti, sotto impatto ambientale.
 Condensatori in un circuito elettronico. Autore: Pdphotos. Fonte: Pixabay.
Condensatori in un circuito elettronico. Autore: Pdphotos. Fonte: Pixabay. Tuttavia, hanno una bassa conducibilità. Questo è risolto usando nanoparticelle di tali composti, poiché aumenta così la superficie e diminuisce la distanza richiesta per la diffusione, il che garantisce un'alta velocità di trasferimento di elettroni e/o ioni.
Può servirti: materiali elasticiNell'ossidazione degli ioni metallici
Una delle applicazioni commerciali del nichel oxoidrossido (III) si basa sulla sua capacità di ossidare gli ioni cobalto (II) in soluzione agli ioni cobalto (III).
Rischi
In soluzione il nichel è più stabile come uno ione o2+, Pertanto non è normale entrare in contatto con NI3+. Tuttavia, le precauzioni sono le stesse, perché il nichel, metallico, in soluzione o sotto forma dei suoi sali solidi, può causare sensibilizzazione della pelle.
È consigliabile utilizzare attrezzature e indumenti protettivi, come scudo facciale, guanti e scarpe di sicurezza. Tutto ciò deve essere usato ogni volta che c'è la possibilità di entrare in contatto con soluzioni di nichel.
Se si verifica dermatite, dovrebbe essere trattato con un medico per escludere che è causato da nichel.
Per quanto riguarda la possibilità di inalazione, è una buona pratica.
Tutti i composti di nichel sono classificati dall'International Cancer Research Agency o IARC (acronimo di inglese Agenzia internazionale per la ricerca sul cancro), nella categoria dei cancerogeni per l'essere umano.
Questo si basa su dati epidemiologici e sperimentali.
Riferimenti
- Cotone, f. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- Lyalin, b.V. et al. Elettrosintesi di azopirazoli attraverso l'ossidazione di N-alchilaminopirazoli su un anodo bambino (OH) in un metodo verde alcali-A acquoso per l'omocouple N-N. Lettere di tetraedro. 59 (2018) 2741-2744. Recuperato da ScienceDirect.com.
- Liuyang, Zhang, et al. (2018). Materiali a base di nichel per Supercapacitos. Materiali oggi. Recuperato da ScienceDirect.com
- Ettel, v.A. e MOSOLU, M. A. (1977). Preparazione di nichel nero. O.S. Brevetto n. 4.006.216. 1 febbraio 1977.
- Scharbert, b. (1993). Processo per ossidando i derivati dell'idrossimetilpiridina in derivati di acido piridinecarbossilico su anodi di idrossido di ossido di nichel. O.S. Brevetto n. 5.259.933. 9 novembre 1993.
- Kirk-Othmer (1994). Enciclopedia della tecnologia chimica. Volume 17. Quarta edizione. John Wiley & Sons.
- L'enciclopedia di chimica industriale di Ullmann. (1990). Quinta edizione. Volume a 17. VCH Verlagsgellschaft MBH.
- McBreen, James. (1997). Idrossidi di nichel. Nel manuale dei materiali della batteria. VCH Publisher. Recuperato da OSTI.Gov.
- « Storia, caratteristiche, usi, esempi di macrocomputer
- Computer analogici in primo piano, componenti, tipi »

