Usi idrofili del termine, caratteristiche, esempi

- 3240
- 500
- Lidia Valentini
UN idrofilo o idrofilo È un segmento molecolare o un composto caratterizzato da una forte affinità per l'acqua e i solventi polari. Etimologicamente significa "amanti dell'acqua", il che implica che un idrofilo sarà in grado di dissolvere o interagire in modo efficiente con le molecole d'acqua.
Pertanto, le sostanze idrofile tendono ad essere solubili o miscibili con acqua. Tuttavia, idrofilia, cioè la sua affinità per l'acqua e altri solventi polari.
 Il vetro è un materiale idrofilo perché si bagna facilmente e le gocce che vengono depositate su di esso sono appiattite o scivolate verso il basso. Fonte: Pexels.
Il vetro è un materiale idrofilo perché si bagna facilmente e le gocce che vengono depositate su di esso sono appiattite o scivolate verso il basso. Fonte: Pexels. Pertanto, le superfici idrofile sono più facili da bagnare o inumidite rispetto all'idrofobo, quelle che odiano l'acqua o la respingono. La prima acqua più piatta cade in file, mentre quest'ultima li gira e prominente. La visualizzazione di queste gocce è uno dei principali fattori per differenziare un materiale idrofilo da un idrofobo.
Il concetto di idrofilia è essenziale per la comprensione della chimica superficiale, delle soluzioni, delle interfacce e del carattere anfifillico di sostanze come proteine e acidi grassi.
[TOC]
Usi del termine idrofilo o idrofilo
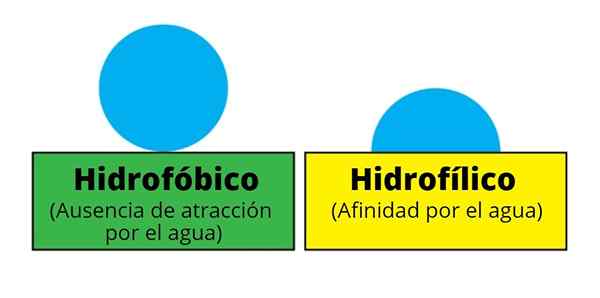
I termini "idrofili" e "idrofili" sono designati sia molecole che porzioni strutturali delle stesse. Tuttavia, "idrofilo" è usato principalmente per riferirsi a qualsiasi molecola o composto che ha molta affinità per l'acqua.
Pertanto, esiste una molecola idrofila o idrofila, se la sua affinità per l'acqua è molto alta secondo alcune considerazioni. Ad esempio, il saccaros.
Può servirti: tritioLa molecola in questione può presentare segmenti o parti idrofili, che possono essere costituite da uno scheletro carbonizzato, o semplicemente da un gruppo polare. Quando si tratta di un gruppo, di solito diciamo che si tratta di un gruppo idrofilo, che contribuisce all'idrofilia della molecola o alla superficie a cui appartiene.
Di solito, "idrofilo" è usato più frequentemente di "idrofilo", poiché quest'ultimo di solito si riserva più di ogni altra cosa per molecole o composti completamente idrofili; Cioè, non hanno regioni idrofobiche nelle loro strutture molecolari. Ciò è particolarmente vero quando vengono descritte le macromolecole o i solidi polimerici.
Caratteristiche delle sostanze idrofile
Covalenza
Le sostanze idrofile sono composti covalenti, il che significa che le loro unità sono costituite da molecole e non di reti ioniche. Pertanto, sebbene i sali tendano ad essere molto solubili in acqua, anche più di molti idrofili.
D'altra parte, non tutti i sali sono solubili in acqua, come il cloruro d'argento, AGCL, motivo per cui non possono essere classificati come idrofili.
Polarità
Perché una molecola sia idrofila, deve avere una certa polarità. Questo è possibile solo se i gruppi polari come -oh, -sh, -nh hanno nella sua struttura2, -COOH, ecc., in modo che contribuiscano al loro momento di dipolo permanente e, quindi, alla loro idrofilia.
Interazioni
Gli idrofili sono riconosciuti al di sopra di altri composti a causa della loro capacità di formare ponti idrogeno con molecole d'acqua. Si noti che i gruppi polari sopra menzionati hanno la capacità di donare idrogeni o accettarli per formare tali ponti, che sono un tipo speciale di interazioni dipolo-dipolo.
Stati solidi
Gli idrofili possono essere sostanze gassose, liquide o solide, i più comuni sono questi ultimi due.
Può servirti: elettrone differenzialeI fluidi idrofili sono miscibili con acqua, quindi quando è miscelato, non si vedranno due fasi.
Nel frattempo, i solidi idrofili si dissolvono in acqua o lo assorbono molto facilmente; Ma inoltre, alcuni hanno la capacità di bagnarsi o bagnarsi senza dissolversi, poiché sebbene la sua superficie sia idrofila, non è proprio la sua massa interna. Questo è il caso di molti materiali polimerici, come i siliconi modificati chimicamente.
Superfici idrofili
Le superfici idrofile sono soggette a studi di chimica superficiale. Non sono solubili in acqua, ma possono inumidire e appiattire le gocce d'acqua che vengono depositate su di esso. Questo perché hanno gruppi idrofili esterni che interagiscono in modo efficiente con le molecole d'acqua.
La goccia d'acqua si forma con la superficie idrofila un angolo di contatto inferiore a 90º, che è uguale per dire che presenterà una forma appiattita, sferica o rotonda.
Tale è quindi, che lascia cadere l'espansione e in esecuzione come file fluide. Ad esempio, questa proprietà viene utilizzata per impedire la nebbia che si offusca la superficie, poiché viene a malapena toccata dall'acqua e scivola giù.
La nostra pelle è idrofila, poiché su di essa le gocce tendono ad appiattire e scivolare; Tranne quando è imbarcato di olio o una crema. Quindi le gocce d'acqua saranno rotonde e definite, perché la superficie è diventata temporaneamente idrofobica.
Esempi di sostanze idrofili
Ammoniaca
L'ammoniaca, NH3, È un idrofilo perché la sua molecola può formare diversi ponti idrogeno con acqua. Questo rende sia in uno stato gassoso che liquido molto solubile in acqua.
Acido ossalico
Acido ossalico, h2C2O4, È un idrofilo.
Può servirti: Pithi Box: caratteristica, funzioni, usa esempiMetanolo
Il metanolo, ch3Oh, è un idrofilo grazie al suo gruppo oh.
Alcoli
Gli alcoli sono generalmente sostanze idrofile, purché il loro scheletro di carbonio non sia molto grande. Ad esempio, 1-propanolo e 2-propanolo sono miscibili con l'acqua, ma ciò non accade con 1-butanolo, la cui miscibilità diventa più bassa a causa della sua catena di carbonio di maggiore lunghezza.
Amido
L'amido è un esempio di polimero idrofilo, poiché le sue unità di glucosio hanno più gruppi OH con i quali i ponti idrogeno si forma con molecole d'acqua.
Legna
Il legno è idrofilo e, sebbene non si dissolva nell'acqua, si inumidi rapidamente se non è trattato con rivestimenti idrofobici.
Proteine
Le proteine hanno gruppi polari molto correlati all'acqua. Pertanto, le sue interazioni con le molecole d'acqua sono efficienti. Ciò non implica, tuttavia, che tutte le proteine siano solubili in acqua, poiché le loro strutture (terziario e quaternario) svolgono un ruolo fondamentale in detto processo di dissoluzione.
Bicchiere
Il vetro è un materiale idrofila perché, sebbene non sia costituito da molecole ma reti SIO2 Tre dimensionali, i loro atomi di ossigeno possono accettare ponti idrogeno d'acqua. Questo è il motivo per cui le navi di vetro sudano in ambienti umidi.
Riferimenti
- Graham Solomons t.W., Craig b. Frigorifero. (2011). Chimica organica. (10th Edizione.). Wiley Plus.
- Carey f. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Morrison e Boyd. (1987). Chimica organica. (Quinta edizione). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Idrofilo. Recuperato da: in.Wikipedia.org
- David L. Chandler. (16 luglio 2013). Spiegato: idrofobico e idrofilo. Recuperato da: Notizie.MIT.Edu
- Gelest. (2020). Materiali idrofili. Recuperato da: gelest.com
- Ahmad Darem et al. (5 settembre 2018). Materiali idrofili e idrofobici e applicazioni. Taylor e Francis online. doi.org/10.1080/15567036.2018.1511642
- « Chaco War Background, Cause, Sviluppo, conseguenze
- Concetto di carichi viventi, caratteristiche, esempi »

