Afnio

- 2991
- 459
- Kayla Serr
 Campione di hafnio metallico. Fonte: immagini ad alta risoluzione degli elementi chimici [CC di (https: // creativeCommons.Org/licenze/di/3.0)]
Campione di hafnio metallico. Fonte: immagini ad alta risoluzione degli elementi chimici [CC di (https: // creativeCommons.Org/licenze/di/3.0)] Cos'è Hafnio?
Lui afnio È un metallo di transizione la cui sostanza chimica è HF e ha un numero atomico di 72. È il terzo elemento del gruppo 4 della tabella periodica, essendo congene nel titanio e succini. Con quest'ultimo condivide molte proprietà chimiche, essendo situate insieme nei minerali della crosta terrestre.
Alla ricerca di Hafnio sta guardando dove lo zirconio, perché è un sottoprodotto della sua estrazione. Il nome di questo metallo deriva dalla parola latina "Hafnia", il cui significato è il nome di Copenaghen, una città in cui è stata scoperta nei minerali di zircone e la controversia si è conclusa rispetto alla sua vera natura chimica.
Questo metallo prende la distinzione di essere l'ultimo degli elementi più stabili scoperti qui sulla Terra; Cioè, le altre scoperte hanno costituito una serie di ultrapesados, isotopi radioattivi e/o artificiali.
I composti di Hafnio sono analoghi al titanio e al cironio, prevalentemente il numero di ossidazione +4, come HFCL4, HFO2, Hfi4 e hfbr4. Alcuni di essi guidano l'elenco dei materiali più refrattari mai creati, nonché leghe di grande resistenza termica e fungono anche da eccellenti assorbenti di neutroni.
Per questo motivo, l'Hafnio ha molta partecipazione alla chimica nucleare, in particolare ai reattori dell'acqua di pressione.
Scoperta
Transition Metal o Rare Earths
La scoperta dell'Hafnio era circondata da controversie, sebbene la sua esistenza fosse già prevista dal 1869 grazie al tavolo periodico di Mendeleev.
Il problema era che era posizionato sotto lo zirconio, ma coincise nello stesso periodo degli elementi delle terre rare: Lantanoides. I chimici all'epoca non sapevano se si trattava di un metallo di transizione o di un metallo dalle terre rare.
 99,9% di hafnium bar. Source- Alchemist-HP (www.PSE-Mendelejew.di), cc by-sa 2.0, via Wikimedia Commons
99,9% di hafnium bar. Source- Alchemist-HP (www.PSE-Mendelejew.di), cc by-sa 2.0, via Wikimedia Commons Il chimico francese Georges Urbain, scopritore di Lutocia, il vicino metallo dell'Hafnio, disse nel 1911 che aveva scoperto l'elemento 72, che Celtio chiamò e proclamò che era un metallo delle terre rare. Ma tre anni dopo si è concluso che i suoi risultati erano sbagliati e che aveva isolato solo una miscela di Lantanoides.
Fu fino a quando gli elementi furono ordinati dai loro numeri atomici, grazie al lavoro di Henry Moseley nel 1914, che il quartiere tra Luthate e Element 72 era la prova dello stesso gruppo del titanio e dei metalli della circostazione.
Può servirti: flocculazione: reazione, tipi, applicazioni, esempiRilevamento a Copenaghen
Nel 1921, dopo gli studi sulla struttura atomica di Niels Bohr e la sua previsione dello spettro di emissione di raggi X per l'elemento 72, questo metallo fu fermato nei minerali delle terre rare; E invece, la sua ricerca sui minerali del cironium si è concentrata, poiché entrambi gli elementi hanno dovuto condividere diverse proprietà chimiche.
Il chimico danese Dirk Coster e il chimico ungherese Georg Von Hevesy nel 1923 hanno finalmente riconosciuto lo spettro previsto da Niels Bohr in campioni di zircone dalla Norvegia e dalla Groenlandia. Avendo fatto la scoperta a Copenaghen, hanno chiamato l'elemento 72 con il nome latino di questa città: Hafnia, che in seguito ha derivato "Hafnio".
Isolamento e produzione
Tuttavia, non è stato un compito facile. Sebbene nel 1924 fu ideato un metodo per ricristallizzazione frazionaria per ottenere il tetracloruro di Hafnio, HFCL4, Furono i prodotti chimici olandesi Anton Eduard Van Arkel e Jan Hendrik de Boer che lo ridusero all'hafnium metallico.
Per fare questo, l'HFCL4 Ha subito una riduzione usando il magnesio metallico (processo Kroll):
Hfcl4 + 2 mg (1100 ° C) → 2 mgcl2 + HF
D'altra parte, a partire da Hafnio Tetrayoduro, HFI4, Ciò è stato vaporizzato per subire una decomposizione termica su un filamento a incandescenza di tungsteno, su cui è stato depositato l'afnio metallico per causare una barra di aspetto policristallino (processo a barra cristallina o processo di archel-boer):
Hfi4 (1700 ° C) → HF + 2 i2
Struttura Hafnio
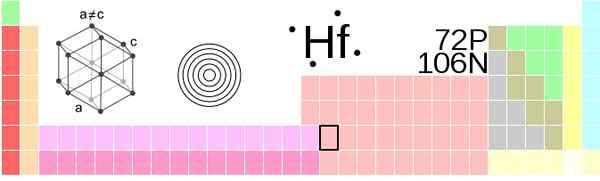 Posizione di Hafnio nella tavola periodica. Fontana: !Originale: Ahoteseiervector: Sushant Savla, CC BY-SA 3.0, via Wikimedia Commons
Posizione di Hafnio nella tavola periodica. Fontana: !Originale: Ahoteseiervector: Sushant Savla, CC BY-SA 3.0, via Wikimedia Commons Hafnio, gli atomi di HF, sono raggruppati in pressione ambientale su una struttura esagonale compatta cristallo, HCP, proprio come fanno i metalli in titanio e zirconio. Questo cristallo HCP hafnio diventa la sua fase α, che rimane costante fino a una temperatura di 2030 K, quando subisce una transizione alla fase β, con una struttura cubica centrata nel corpo, BCC.
Questo è inteso se il calore "rilassa" il vetro è considerato e, quindi, gli atomi di HF cercano di posizionarsi in modo tale che la loro compattazione diminuisca. Queste due fasi sono sufficienti per considerare il polimorfismo dell'afnio.
Presenta anche un polimorfismo che dipende dalle alte pressioni. Le fasi α e β esistono ad una pressione di 1 atm; Mentre il ω, una fase esagonale ma ancora più compatta dell'HCP ordinario, appare quando le pressioni superano i 40 GPA. È interessante notare, quando le pressioni continuano ad aumentare, la fase β riappare, la meno densa.
Può servirti: acido seleenidrico (H2SE): cosa è, struttura, proprietà, usiProprietà Hafnio
Aspetto fisico
Solid Silver White Solid, che mostra toni scuri se ha uno strato di ossido e nitruro.
Massa molare
178,49 g/mol
Punto di fusione
2233 ºC
Punto di ebollizione
4603 ºC
Densità
A temperatura ambiente: 13,31 g/cm3, essendo due volte più denso di The Eclur
Proprio al punto di fusione: 12 g/cm3
Calore di fusione
27,2 kJ/mol
Calore di vaporizzazione
648 kJ/mol
Elettronegatività
1.3 sulla scala Pauling
Energie di ionizzazione
Primo: 658,5 kJ/mol (HF+ gassoso)
Secondo: 1440 kJ/mol (HF2+ gassoso)
Terzo: 2250 kJ/mol (HF3+ gassoso)
Conduttività termica
23,0 W/(M · K)
Resistività elettrica
331 nω · m
Durezza MOHS
5.5
Reattività
A meno che il metallo non sia pula e ustioni, sparando scintille a una temperatura di 2000 ºC, non ha suscettibilità all'ossidazione o all'esecuzione, poiché uno strato sottile del suo ossido lo protegge. In questo senso, è uno dei metalli più stabili. In effetti, acidi o basi forti possono dissolverlo; Con l'eccezione dell'acido fluorrorico e degli alogeni in grado di ossidarsi.
Configurazione elettronica
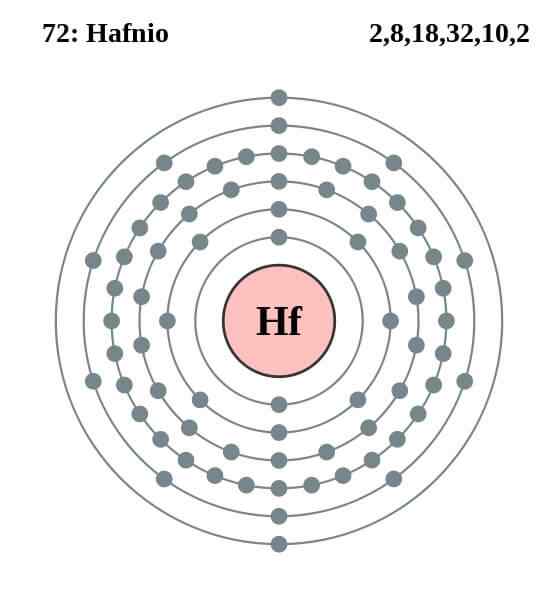 Configurazione elettronica di Hafnio
Configurazione elettronica di Hafnio L'atomo di Hafnio ha la seguente configurazione elettronica:
[Xe] 4f14 5 D2 6s2
Ciò coincide con il fatto di appartenenza al gruppo 4 della tavola periodica, insieme al titanio e al cirrium, perché ha quattro elettroni di Valencia negli orbitali 5D e 6S. Si noti che Hafnio non potrebbe essere un Lantanoide, poiché ha i suoi orbitali 4F completamente completi.
Numeri di ossidazione
La stessa configurazione elettronica rivela quanti elettroni è in grado di perdere un atomo di hafnio quando fa parte di un composto. Supponendo che perda i suoi quattro elettroni di Valencia, sarebbe un catione tetravalente HF4+ (In analogia a te4+ e zr4+), E quindi avrebbe un numero di ossidazione di +4.
Questo è in realtà il più stabile e comune dei suoi numeri di ossidazione. Altri meno pertinenti sono: -2 (HF2-), +1 (HF+), +2 (HF2+) e +3 (HF3+).
Isotopi
Hafnio è presentato sulla Terra come cinque isotopi stabili e uno radioattivo con un periodo di vita molto grande:
-174HF (0,16%, con una mezza vita di 2 · 10quindici anni, quindi è considerato praticamente stabile)
-176HF (5,26%)
-177HF (18,60%)
Può servirti: basi deboli-178HF (27,28%)
-179HF (13,62%)
-180HF (35,08%)
Si noti che non esiste un tale isotopo in quanto tale che si distingue in abbondanza, e questo si riflette nella massa atomica media di Hafnio, 178.49 Uma.
Di tutti gli isotopi radioattivi dell'Hafnio, che insieme ai nativi in totale un totale di 34, il 178m2HF è il più controverso perché nel suo decadimento radioattivo rilascia radiazioni gamma, quindi questi atomi potrebbero essere usati come una pistola di guerra.
Usi/applicazioni
 Hafnio coperto con un sottile strato di ossido. Fonte: Alchemist-HP (talk) (www.PSE-Mendelejew.De), fal, via Wikimedia Commons
Hafnio coperto con un sottile strato di ossido. Fonte: Alchemist-HP (talk) (www.PSE-Mendelejew.De), fal, via Wikimedia Commons Reazioni nucleari
Hafnio è un metallo resistente all'umidità e alte temperature, oltre ad essere un eccellente assorbimento di neutroni. Per questo motivo, viene utilizzato nei reattori dell'acqua di pressione, nonché nella produzione di barre di controllo per i reattori nucleari, nei cui rivestimenti sono fatti di ultrapuro.
Leghe
Gli atomi di Hafnio possono integrare altri cristalli di metallo per dare origine a diverse leghe. Questi sono caratterizzati da tenace e termicamente resistenti, quindi sono destinati a applicazioni spaziali, come nella costruzione di ugelli per i razzi.
D'altra parte, alcune leghe e composti solidi di Hafnio hanno proprietà speciali; come i loro carburi e Nituros, HFC e HFN, rispettivamente, che sono materiali molto refrattari. Tantalo e Hafnio Carbide, TA4Hfc5, Con un punto di fusione di 4215 ºC, è uno dei materiali più refrattari mai conosciuti.
Catalisi
I metaloceni di Hafnio sono usati come catalizzatori organici per la sintesi di polimelene come polietilene e polistirene.
Rischi
Non è noto fino ad oggi quale impatto gli ioni HF potrebbero avere nel nostro corpo4+. D'altra parte, poiché si trovano in natura nei minerali di zirconio, non si ritiene che possano alterare l'ecosistema di liberare i loro sali nell'ambiente.
Ora, si raccomanda di manipolare attentamente i composti di Hafnio, come se fossero tossici, anche se non ci sono studi medici che dimostrano che sono dannosi per la salute.
Il vero pericolo di Hafnio sta nelle particelle del suo solido finemente macinato, che può bruciare proprio quando entrano in contatto con l'ossigeno dell'aria.
Questo spiega perché quando è lucido, l'azione che graffia la superficie e emette particelle di metallo puro, le scintille di combustione vengono rilasciate con una temperatura di 2000 ºC; Cioè, l'Hafnio presenta la piroporicità, l'unica proprietà che comporta il fuoco o gravi rischi di ustioni.

