Caratteristiche, struttura, funzione e alterazioni della globina
- 2821
- 394
- Benedetta Rinaldi
IL Globin È una struttura della natura proteica disposta in forma sferica o globulare, essendo da dove proviene il suo nome. Questa struttura è di tipo terziario ed è caratterizzata dall'essere complessa, poiché la catena di aminoacidi si piega per formare sferoproteine. Esistono diversi tipi di catene globiniche e questi sono stati classificati in lettere greche: Alfa, Beta, Delta, Gamma, Epsilon e Zeta.
Gli aminoacidi che compongono la struttura primaria della proteina variano in base alla specie a cui appartengono (umani o animali). Ci sono anche variazioni all'interno della stessa specie in base all'attuale stato di vita dell'organismo (vita embrionale, vita fetale o post nascita).
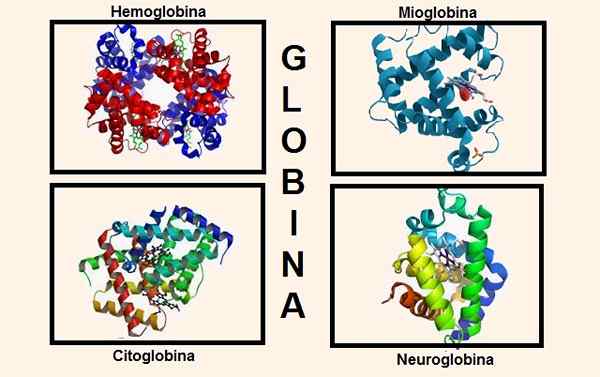
 Strutture diverse contenenti globin nella sua composizione. Fonti: Wikipedia.com/biancadescali [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]/Il caricatore originale era Proteinboxbot in inglese Wikipedia. [Dominio pubblico]/wikipedia.com
Strutture diverse contenenti globin nella sua composizione. Fonti: Wikipedia.com/biancadescali [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]/Il caricatore originale era Proteinboxbot in inglese Wikipedia. [Dominio pubblico]/wikipedia.com Le informazioni genetiche per la sintesi delle varie catene di globina sono contenute in vari cromosomi. Ad esempio, i globuli della catena alfa si trovano sul cromosoma 16, mentre le informazioni genetiche di beta, delta, gamma ed epsilon sono sul cromosoma 11.
[TOC]
Caratteristiche
La globina fa parte di strutture importanti nel corpo, ad esempio le più rilevanti sono: emoglobina e mioglobina.
L'emoglobina contiene quattro catene globiniche (ALFA 1 e ALFA 2) e (Beta 1 e Beta 2). Ogni globina ha una replica in cui protegge il gruppo Hemo.
D'altra parte, c'è mioglobina. Che ha una struttura meno complessa dell'emoglobina. Questo presenta un polipeptide globulare singolo disposto secondario.
Fino a poco tempo fa si credeva che queste fossero le uniche sostanze che contenevano globina negli esseri superiori, ma oggi sono note altre due che hanno globina nella loro costituzione: citoglobina e neuroglobina.
La citoglobina è presente nella maggior parte dei tessuti ed è particolarmente situata nel tessuto connettivo, così come è stato trovato nella retina.
A sua volta, la neuroglobina ha la preferenza per il tessuto nervoso, da cui il suo nome. La neuroglobina è stata trovata nelle cellule nervose cerebrali situate a livello della corteccia cerebrale, nonché in altre località come il talamo, l'ipotalamo, l'ippocampo e il cervelletto.
Può servirti: tassonomia di Linnean degli esseri viventiTuttavia, non sono le uniche posizioni, perché al di fuori del sistema nervoso si trova nelle isole di Langerhans del pancreas e nella retina.
Struttura
Esistono 6 diversi tipi di catene di globina che sono designate con le lettere dell'alfabeto greco: alfa (α), beta (β), gamma (γ), delta (Δ), epsilon (ε) e zeta (ζ). Queste catene appartengono alla famiglia di Globinas, ma differiscono l'una dall'altra nel numero di aminoacidi che possiedono.
Questi polipeptidi hanno una struttura primaria, secondaria e terziaria. La semplice catena di aminoacidi rappresenta la struttura primaria. Quando la catena viene lanciata formando spirali o eliche costituiscono la struttura secondaria.
Se questa struttura quindi si piega più volte su se stessa, forma una struttura globulare corrispondente alla struttura terziaria.
Allo stesso modo, possono acquisire la forma quaternaria solo quando 4 molecole o catene globiniche sono combinate in forma terziaria.
Questo è presentato nella complessa struttura dell'emoglobina. Tuttavia, nella mioglobina è diverso. In questo caso, la globina è presentata come monomero, cioè ha una singola catena peptidica disposta in pieghe, creando 8 eliche (struttura secondaria).
Sia l'emoglobina che la mioglobina ospitano un gruppo hemo all'interno della loro struttura complessa.
Emoglobina
In questa molecola, sono unite 2 catene alfa globiniche e 2 catene beta. È così che sono perfettamente accoppiati per ospitare il gruppo Hemo al centro, oltre al ferro.
Tra queste strutture ci sono sindacati deboli e sindacati. Nei sindacati deboli, partecipano 19 aminoacidi e l'unione si verifica come segue: la catena ALFA 1 si unisce alla catena beta 2 e la catena ALFA 2 si unisce alla catena beta 1.
Mentre, 35 aminoacidi e le catene che si uniscono sono: ALFA 1 Chain si unisce alla catena Beta 1 e la catena ALFA 2 si unisce alla catena beta 2 2.
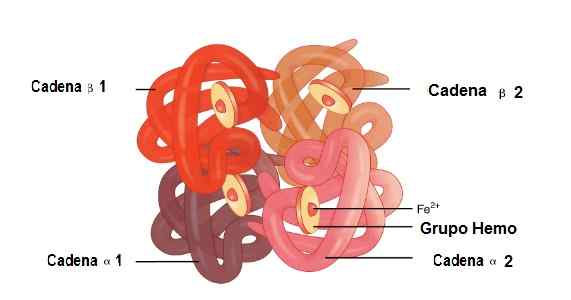 Posizione delle catene ALFA 1 e Alfa 2, Beta 1 e Beta 2 nella struttura dell'emoglobina. Fonte: Openx College [CC di 3.0 (https: // creativeCommons.Org/licenze/di/3.0)] immagine modificata (tradotta in spagnolo)
Posizione delle catene ALFA 1 e Alfa 2, Beta 1 e Beta 2 nella struttura dell'emoglobina. Fonte: Openx College [CC di 3.0 (https: // creativeCommons.Org/licenze/di/3.0)] immagine modificata (tradotta in spagnolo) Mioglobina
Nella mioglobina è presente anche un gruppo di proteine globulari, ma in questo caso esiste una singola catena peptidica composta da 153 aminoacidi. La sua disposizione spaziale è secondaria e presenta 8 eliche alfa.
Può servirti: oligoements: a cosa servono, a cosa servono e cosa sonoQuesta struttura proteica colloca strategicamente gli aminoacidi idrofobici nella struttura, mentre gli aminoacidi idrofili o polari si trovano verso l'esterno.
Questo design è perfetto per ospitare il gruppo Hemo all'interno (parte idrofobica). Questo si lega alla proteina per legami non covalenti.
Cytoglobin
È stato scoperto nel 2001 e si dice che si tratti di un tipo di emoglobina, ma differisce in quanto è esacoordinato, mentre l'emoglobina e la mioglobina sono pentacoordinati. Questo ha a che fare con la posizione adottata dall'amminoacido dell'istidina vicino al gruppo Hemo.
Neuroglobin
La sua scoperta è stata fatta nel 2000. La neuroglobina è un monomero che ha 150 aminoacidi, quindi è molto simile alla mioglobina. La struttura della neuroglobina ha una somiglianza tra il 21 e il 25% con la mioglobina ed emoglobina.
Funzioni
Poiché la globina non è sola nel corpo, ma fa parte di determinate strutture, sono menzionate le funzioni che ciascuno di esse svolgono:
Emoglobina
Si trova all'interno degli eritrociti. È responsabile del fissaggio e del trasporto di ossigeno dai polmoni ai tessuti. Così come il corpo di anidride carbonica, realizzare la via opposta.
Mioglobina
Il gruppo Hemo situato in globina ha la funzione di conservare le molecole di ossigeno per ossigenare il muscolo cardiaco e il muscolo scheletrico.
Cytoglobin
Si ritiene che questa proteina influenzi la protezione dell'ipossia e gli stati di stress ossidativo nei tessuti. Si pensa anche che l'ossigeno arterioso possa trasportare nel cervello.
Neuroglobin
Si pensa che la neuroglobina abbia la capacità di fissare ossigeno, monossido carbonio e ossido nitrico.
Tuttavia, non è ancora noto con certezza quale sia la funzione della neuroglobina, ma si ritiene che sia correlato alla regolazione dell'ipossia e dell'ischemia cerebrale. Soprattutto agirebbe come neuroprotettore.
Può servirti: teoria del trasformismo di LamarckPoiché la neuroglobina ha una struttura simile all'emoglobina e alla mioglobina, si ipotizza che possa partecipare alla fornitura di ossigeno a livello neuronale. Si ritiene inoltre che possa eliminare i radicali liberi e l'azoto che si verificano nella catena respiratoria.
In relazione all'ossido nitrico, si pensa che lo eliminino quando l'ossigeno è normale e lo produce nei processi di ipossia da non2.
Modifiche
Le catene alfa e beta della globina sono codificate da diversi geni situati rispettivamente sui cromosomi 16 e 11.
Gli individui che hanno l'emoglobina S (anemia falciforme o drapanocitica) hanno un difetto nella catena beta di globina. Il difetto consiste in una sostituzione di basi di azoto a livello di nucleotide numero 20 del gene coinvolto, dove vi è un cambiamento di adenina da parte di una timina.
Mutazioni nel gene βS di cromosoma 11 proviene diverse alopetti di globinas chiamati: Senegal, Camerun, Benín, Bantú o Car e Asian o Arabo-Indian.
Conoscere il tipo di aplotipo presentato dai pazienti con anemia falciforme è importante epidemiologico, poiché consente di conoscere la distribuzione di diversi aplotipi, ma anche queste informazioni forniscono dati importanti per conoscere la prognosi della malattia.
Ad esempio: è noto che l'alotipo Bantu è più grave, mentre il tipo senegal e asiatico è più mite.
Le differenze tra un aplotipo e un'altra risiedono nella quantità di emoglobina F che possiedono. Una percentuale più alta di emoglobina F e una prognosi più emoglobina S migliore. Meno emoglobina F e più prognosi peggiore di emoglobina.
Queste mutazioni sono ereditate autosomicamente insieme alla mutazione di emoglobina S.
Riferimenti
- "Globin." Wikipedia, Enciclopedia gratuita. 19 ottobre 2018, 13:44 UTC. 11 lug 2019, 17:26, Wikipedia.org
- "Mioglobina." Wikipedia, Enciclopedia gratuita. 7 luglio 2019, 21:16 UTC. 11 lug 2019, 20:42, Wikipedia.org
- Durán C, Morales O, Echeverri S, Isaza M. Halotipi del gene beta globina nei portatori di emoglobina in Colombia. Biomedico 2012; 32: 103-111. Disponibile su: scielo.org
- Forrellat M, Hernández P. Neuroglobin: nuovo membro della famiglia Globinas. REV CUBAN REV IMMUNOL HOMOTHER 2011; 27 (3): 291-296. Disponibile su: scielo.SLD
- “Cytoglobin." Wikipedia, Enciclopedia gratuita. 1 settembre 2017, 17:26 UTC. 12 lug 2019, 00:28 Wikipedia.org
- « Caratteristiche, struttura, funzioni di eteropolisaccaridi
- Sintomi di schizofrenia paranoica, cause e trattamenti »

