Struttura, funzioni, classi ed esempi di glicoproteine
- 1839
- 226
- Lidia Valentini
IL glicoproteine O Glucoproteine Sono proteine transmarket che fanno parte della grande famiglia di glyconjugati di membrana e sono presenti in animali, piante e microrganismi come batteri, lieviti e archi.
Furono definiti per la prima volta nel 1908 dal Comitato per la nomenclatura delle proteine dell'American Biochimical Society e sono il risultato dell'Unione glicosidica di una proteina con una porzione di carboidrati chiamata Glucano.
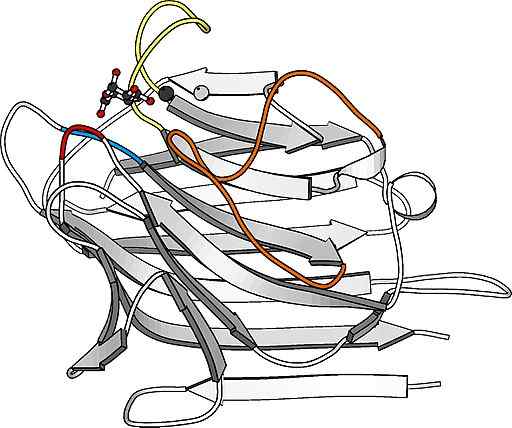
 Struttura del monomero Lectina
Struttura del monomero Lectina Sono proteine particolarmente abbondanti sulla superficie della membrana plasmatica di molte cellule e costituiscono una parte importante dello strato di carboidrati che le copre e che in molti casi si chiama Glucocálix.
Le proteine precursori delle glicoproteine sono modificate in modo covalente nel reticolo endoplasmatico e nel complesso del Golgi di molti eucarioti dopo la loro traduzione, sebbene ci siano anche casi di glicosilazione nel citosol, ma sono meno comuni e si verificano con un singolo tipo di zucchero.
La glicosilazione delle proteine ha spesso importanti effetti funzionali nella sua attività, poiché può partecipare alla piegatura e, quindi, nella creazione della sua struttura terziaria.
I glucani hanno molteplici funzioni biologicamente importanti per la cellula, poiché possono conferire specificità alle cellule e partecipare a processi di segnalazione intra e intercellulare, poiché sono ligandi per recettori endogeni ed esogeni.
Le glicoproteine, così come il resto dei glyconjugados, sono così importanti che una cellula dedica fino all'1% del suo genoma ai macchinari di glicosilazione e, nell'uomo, oltre il 70% delle proteine è modificata dalla glicosilazione.
[TOC]
Struttura
La struttura delle glicoproteine è studiata in base alla loro sequenza di aminoacidi, ai siti di glicosilazione all'interno della sequenza e alle strutture delle porzioni del glucano che sono unite in questi luoghi.
Le catene di oligosaccaridi che si legano per glicosilazione a queste proteine sono generalmente molto diverse, ma sono brevi, poiché non superano i 15 rifiuti di zucchero. Alcune proteine hanno una singola catena oligosaccaride, ma altre potrebbero averne più di una e queste possono essere ramificate.
L'unione tra oligosaccaridi e proteine si verifica attraverso il carbonio di carboidrati anomerici e il gruppo idrossile (-OH) di un residuo di serina o treonina, nel caso del O-glicosilazione, o attraverso l'azoto amida del residuo di asparagina, nel caso del N-glicosilazione.
I carboidrati uniti possono rappresentare fino al 70% del peso molecolare di una glicoproteina e le caratteristiche della porzione di carboidrati (dimensioni e carico, ad esempio) possono proteggere alcune proteine dalla proteolisi enzimatica.
Può servirti: agar di farina di mais: fondazione, preparazione e utilizzoLa stessa proteina può avere, in diversi tessuti, diversi schemi di glicosilazione che la rendono una glicoproteina diversa, poiché la struttura completa include non solo i rifiuti di aminoacidi e le loro disposizioni spaziali, ma anche per gli oligosaccaridi attaccati a questi.
Tra i residui di zucchero che si trovano ripetutamente nelle glicoproteine ci sono: d-galattosio, d-kinea, d-glucosio, l-fucosio, d-xilosa, l-arabinofuranosa, n-acetil-d-glicosamina, n-acetil-galattosaminaminaminamin , alcuni acidi sialici e modifiche di tutti questi.
Funzioni
Strutturale
Dal punto di vista strutturale, le glicoproteine forniscono catene di carboidrati che partecipano alla protezione e alla lubrificazione delle cellule, poiché queste sono in grado di idratare e formare una sostanza viscosa che resiste alle aggressioni meccaniche e chimiche.
Nei batteri e negli archi ci sono anche alcune glicoproteine e questi sono componenti importanti dello strato s, che è lo strato più esterno della copertura cellulare.
Inoltre, si trovano anche come componenti delle proteine di flagelina, che fanno parte dei filamenti flagellari che usano come organi locomotori.
Le piante hanno anche glicoproteine strutturali che sono caratterizzate da schemi di glicosilazione complessi e possono essere trovate come parte della struttura della parete cellulare o nella matrice extracellulare.
Riconoscimento cellulare
Le glicoproteine esercitano funzioni trascendentali come siti di riconoscimento tra cellule, poiché molti recettori della superficie cellulare sono in grado di riconoscere specifiche sequenze di oligosaccaridi.
Esempio di riconoscimenti intercellulari che si verificano attraverso le catene degli oligosaccaridi sulla superficie cellulare è il caso del riconoscimento tra ovulo e sperma, necessario per il fenomeno della fecondazione da somministrazione in organismi multicellulari con riproduzione sessuale con riproduzione sessuale.
Il gruppo sanguigno nell'uomo è determinato dall'identità degli zuccheri attaccati alle glicoproteine che li specificano. Gli anticorpi e molti ormoni sono anche glicoproteine e le loro funzioni sono essenziali per la segnalazione e la difesa del corpo.
Adesione cellulare
Le cellule T del sistema immunitario dei mammiferi hanno una glicoproteina con domini di adesione noti come CD2, che è un componente chiave per la stimolazione immunitaria poiché l'unione tra il linfocita e l'antigene che presentano cellule attraverso il suo ricevitore, la glicoproteina CD58.
Alcuni virus che hanno importanti funzioni patogene per molti mammiferi e tra questi gli esseri umani hanno glicoproteine di superficie che funzionano nei processi di adesione della particella virale alle cellule che parassitizzano.
Può servirti: organismi autotroficiTale è il caso della proteina GP120 del virus umano dell'immunodeficienza acquisita o dell'HIV, che interagisce con una proteina superficiale di cellule umane note come GP41 e collabora con l'ingresso del virus alla cellula.
Allo stesso modo, molte proteine glicosilate partecipano a importanti processi di adesione cellulare che si svolgono nella vita ordinaria delle cellule presenti in molti tessuti di organismi multicellulari.
Glicoproteine come bersagli terapeutici
Questi complessi proteina-carboidrato sono i bianchi preferiti da molti agenti patogeni come parassiti e virus e molte glicoproteine con motivi di glicosilazione aberrante hanno funzioni determinanti nelle malattie autoimmuni e nei tumori.
Per questi motivi, vari ricercatori hanno assegnato il compito di raccogliere queste proteine come possibili bersagli terapeutici e per la progettazione di metodi diagnostici, terapie di nuova generazione e persino per la progettazione del vaccino.
Classi
La classificazione delle glicoproteine si basa principalmente sulla natura del collegamento glicosidico che unisce le porzioni di proteine e carboidrati e sulle caratteristiche dei glucani uniti.
Secondo i rifiuti zuccherati, si possono avere glicoproteine con monosaccaridi, disaccaridi, oligosaccaridi, polisaccaridi e derivati da questi. Alcuni autori considerano una classificazione delle glicoproteine in:
- Proteoglicani, che sono una sottoclasse all'interno del gruppo di glicoproteine che contiene, nella porzione di carboidrati, polisaccaridi composti principalmente da aminoazúces (glucosaminoglicani).
- Glicopeptidi, che sono molecole composte da carboidrati attaccati agli oligopeptidi formati dagli aminoacidi nelle loro conformazioni L e/o D.
- Gli aminoacidi di gluco, che sono aminoacidi attaccati a un saccaride attraverso qualsiasi tipo di legame covalente.
- Gli aminoacidi glicosil, che sono aminoacidi attaccati a una porzione di saccaride attraverso legami O-, N- o S-Glycicosidici.
Nella nomenclatura di queste proteine così unite ai carboidrati sono usati i prefissi o-, n e s- per specificare attraverso i quali collegamenti gli zuccheri sono uniti alla catena del polipeptide.
Esempi
- Il gliforino A è uno dei migliori glicoproteine studiate: è una proteina integrale della membrana eritrocitaria (cellule o globuli rossi del sangue) e ha 15 catene di oligosaccaridi collegati covalentemente allo spreco di aminoacidi della regione N-terminale attraverso link O-glicosidico e una catena unita da un collegamento N-glicosidico.
- La maggior parte delle proteine del sangue sono glicoproteine e questo gruppo include immunoglobuline e molti ormoni.
Può servirti: importanza del carbonio negli esseri viventi- Lattoalbumina, una proteina presente nel latte è glicosilada, così come molte proteine pancreatiche e licenziali.
- Le lectina sono proteine dell'Unione dei carboidrati e per loro hanno più funzioni in riconoscimento.
- È inoltre necessario evidenziare molti ormoni animali che sono glicoproteine; Tra questi, può menzionare la lutropina (LH), la folitropina (FSH) e la tirotropina (TSH), che sono sintetizzate nella ghiandola pituitaria anteriore e gonadotropina corionica prodotta nella placenta di umani, primati e cavalli.
Questi ormoni hanno funzioni riproduttive poiché l'LH stimola la steroidogenesi nelle ovaie e le cellule testicolari di Leydig.
- Il collagene, abbondante proteina presente priorità nei tessuti connettivi animali, rappresenta una grande famiglia di glicoproteine composte da più di 15 tipi di proteine che, sebbene abbiano molte caratteristiche in comune, sono abbastanza diverse.
Queste proteine contengono porzioni "non collageniche", alcune delle quali sono formate dai carboidrati.
- Le estensine sono proteine vegetali che consistono in una rete di glicoproteine insolubile che sono ricche di residui di idrossiprolina e serina. Si trovano sul muro delle cellule vegetali e pensano di esercitare funzioni in difesa contro diversi tipi di stress e agenti patogeni.
- Le piante hanno anche proteine di lectina e un esempio speciale di queste sono lectina di patate, che apparentemente hanno la capacità di riunire cellule del sangue come gli eritrociti.
- Infine, ma non meno importante possono essere nominate mucinas, che sono glicoproteine secrete nelle mucose e fanno parte della saliva negli animali, realizzando le funzioni di lubrificazione e segnalazione, principalmente.
Riferimenti
- Montreuil, j., Vliegenthart, J., & Schachter, H. (1995). Glicoproteine. (A. Neuberger & l. Deenen, eds.). Elsevier.
- Nelson, d. L., & Cox, m. M. (2009). Principi di biochimica Lechinger. Omega Editions (5 ° ed.). https: // doi.org/10.1007/S13398-014-0173-7.2
- Struwe, w., & Cosgrave, e. (2011). Proteomica funzionale e strutturale delle glicoproteine. (R. Owens e J. Nettleship, eds.). Londra: Springer.
- Voet, d., & Voet, J. (2006). Biochimica (3 ° ed.). Pan -American Medical Editoriale.
- Wittman, v. (2007). Glicopeptidi e glicoproteine. Sintesi, struttura e applicazione. (V. Balzani, J.-M. Lehn, a. Da meijere, s. Legge, k. Houk, s. Schreiber, j. Thiem, eds.). Lipsia: Springer Science + Business Media, LLC.
- « Il ritardo tecnologico ed educativo in Africa e America Latina
- Struttura degli acidi grassi, tipi, funzioni, biosintesi »

