Struttura di gliceraldeide, caratteristiche, funzioni
- 4468
- 1290
- Baldassarre Ross
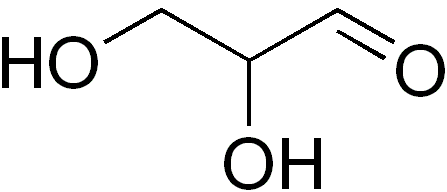
Lui gliceraldeide È l'unico monosaccaride a tre carbonio, essendo a sua volta l'unica triosa. È anche un aldotriosa perché ha un gruppo di aldeide. La parola gliceraldeide proviene dalla combinazione di glicerina e aldeide. Questo perché la gliceraldeide è simile alla glicerina, ma il carbonio uno (C-1) è un aldeide.
La sintesi chimica della gliceraldeide viene effettuata con diversi metodi, ad esempio usando enzimi. La gliceraldeide è una molecola piuttosto reattiva, essendo in grado di formare oltraggioso tra le proteine.
 Fonte: DRTW presso olandese Wikedia [CC BY-SA 3.0 (http: // creativeCommons.Org/licenze/by-sa/3.0/]]
Fonte: DRTW presso olandese Wikedia [CC BY-SA 3.0 (http: // creativeCommons.Org/licenze/by-sa/3.0/]] [TOC]
Struttura
Il gliceraldeide ha un centro asimmetrico o chirale (Atomo di carbonio 2, C-2). Forma due enantiomeri d (dextrogyr) e l (levógiro), che ruotano il piano della luce polarizzata in direzioni opposte: la d-glicentelaldeide lo gira a destra e la L-glicentealdeide a sinistra.
La rotazione ottica specifica della d-gliceraldeide, a 25 ºC, è +8,7º e la rotazione ottica specifica della gliceraldeide D, a 25 ° C, è -8,7º. La d-gliceraldeide si trova spesso in natura, principalmente come gliceraldeide 3-fosfato.
La configurazione L-gliceraldeide viene utilizzata come riferimento standard per i carboidrati. Nelle molecole biologiche, D-Sugar abbonda. Atomo di carbonio 3 (C-3) di gliceraldeide è un gruppo di idrossimetilene (-CH2OH).
Caratteristiche
I cristalli di gliceraldeide sono incolori e hanno un sapore dolce. La formula empirica di questo zucchero è C3H6O3 e il suo peso molecolare è di 90 g/mol.
In soluzione acquosa, la glicetide DL è presente principalmente come aldeidrolo, che è una forma idratata di aldeide. Cristallino dl-gliceraldehido è dimec.
L'analisi dei cristalli di gliceraldeide da parte dei raggi X ha dimostrato che ha anelli 1.4-diossani con tutti i sostituenti in orientamento equatoriale.
In soluzione acquosa, la gliceraldeide sperimenta l'auto -ossidazione che genera radicale libero. Questo è associato a un rapido consumo di ossigeno.
Può servirti: protocooperazioneLa velocità di consumo di ossigeno diminuisce lentamente in presenza di dismutasi superossido. Ciò suggerisce che esiste una formazione di superossido durante l'autoossidazione della gliceraldeide. Il passaggio limitante del gliceraldeide autoxid
La sintesi di D-gliceceraldeide è catalizzata da aminoacidi primari e secondari, essendo favoriti a bassi valori di pH (da 3 a 4).
Funzioni
In cross -linking tra proteine
L'interazione proteina-proteina è un meccanismo molecolare di più complessi processi biologici. Queste interazioni possono essere transitorie, essendo l'interazione della proteina da una via metabolica o traduzione del segnale.
La reticolazione chimica costituisce un metodo diretto per identificare le interazioni transitorie e stabili-proteine.
La tecnica del collegamento incrociato tra la proteina consiste nella formazione di legami covalenti, per i quali vengono utilizzati agenti che hanno gruppi reattivi bifuncionali che reagiscono con gruppi amminici e gruppi di rifiuti di aminoacidi di proteine.
In particolare, gli agenti reagiscono con i gruppi di aming primari (come l'epsilone-amino dello spreco delle lisine) e la forma si intersecano sia all'interno di una subunità di proteine che tra le subunità proteiche.
Esistono un'ampia varietà di agenti disponibili in commercio. Sebbene la gliceraldeide sia un agente trasversale, ci sono altri agenti più popolari, come la glutaraldeide. Questo perché la gluteraldeide mantiene la rigidità strutturale della proteina, che è un requisito importante in molti studi.
Altri agenti popolari sono gli imitatori omobifunzionali, che variano nella lunghezza del braccio distanziatore tra i loro gruppi reattivi. Alcuni esempi di imidoestri sono il dimetil apimidato (DMA), il dimetil suberimidato (DMS) e il dimetil pimilimidato (DMP).
Può servirti: omopolisaccaridi: caratteristiche, struttura, funzioni, esempiIn cross -linking tra le microsfere di gelatina
Le microsfere di gelatina hanno il potenziale per servire per il rilascio di farmaci controllati. Questo perché queste microsfere non sono tossiche e che i loro prodotti sono facilmente escreti. Tuttavia, la gelatina è un polimero solubile, quindi deve essere modificato chimicamente per fungere da sistema di spedizione di farmaci.
D, L-Glyceraldeide può essere considerato un agente di reticolazione non tossico (la dose letale, dl50 i.P. Nei ratti è 2000 mg/kg). Inoltre, nel corpo umano, la d-gliceraldeide è fosforilata dalla triosa chinasi. In questo modo, si forma il gliceraldeide 3-fosfato che entra nella glicolisi.
Il trattamento delle microsfere di gelatina con d, l-gliceceraldeide per 24 ore produce microsfere con una serie di aminoacidi lisina liberi ridotti. Pertanto, la capacità delle microsfere di prolungare, ad esempio l'effetto dell'idrocluride di clodinina, che è antiipertensiva.
Le microsfere sono state somministrate mediante iniezione sottocutanea ad albine e ratti in beffa. Dopo l'iniezione, la pressione arteriosa sistolica è diminuita per due ore, riprendendo il suo valore basale. Sono stati analizzati i tessuti del luogo di iniezione e non sono state trovate microfette, sebbene sia stata osservata infiammazione.
Nelle reazioni prebiotiche
In condizioni prebiotiche - come quelle che dovrebbero avere la terra primitiva - la formaldeide avrebbe potuto servire per la sintesi di gliceraldeide, un intermediario chimico coinvolto nei processi chimici che avrebbero potuto originare la vita.
L'ipotesi precedente si basa sul fatto che sia la glicolisi che la fotosintesi hanno il 3-fosfato di gliceraldeide come intermediario metabolico.
È stato proposto un modello chimico che spiega la biosintesi della gliceraldeide dalla formaldeide attraverso un percorso ciclico. La sintesi di gliceraldeide avviene mediante aggiunta di formaldeide a una triosa (gliceraldeide ↔ diidrossicetone) per produrre una tetrosa (↔ aldotrosa ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ tivamente.
Può servirti: erithro: caratteristiche, struttura, funzioniL'aggiunta di formaldeide al glicaldeide completa il ciclo. Si verifica la sintesi di due molecole di triosa di sei molecole di formaldeide.
In generale, si ritiene che la sintesi prebiotica degli zuccheri sia coinvolta la reazione di formosa, in cui la formaldeide in presenza di una piccola quantità di glicaldeide viene convertita in zuccheri dalle reazioni di condensa aldolica.
È stato proposto che l'ossidazione dello zucchero prebiotico (glicaldeide, triosa, tetrosas) abbia prodotto poliidrossiacidi che agiscono come sostanze autoatalitiche.
La conversione del gliceraldeide in acido lattico e acido glicerico, ad ossido dipendente dall'idrossido di ferro, punta agli oligoéstere di questi idrossiacidi ebbe luogo sulla superficie di questo materiale.
Riferimenti
- Breslow, r., Ramalingam, v., APPAEEE, c. 2013. Catalisi della sintesi del gliceraldeide da aminoacidi primari o secondari in condizioni prebiotiche una funzione di pH. Origine della biosfera Evolution Life Evolution. Doi 10.1007/S11084-013-9347-0.
- Carey, f. A., Giuliano, r. M. 2016. Chimica organica. McGraw-Hill, New York.
- Robyt, j.F. 1998. Essenziale di chimica dei carboidrati. Springer, New York.
- Thornalley, p., Wolff, s., Crabbe, j., Stern, a. 1984. L'autoossidazione di gliceraldeide e altri semplici monosaccaridi sotto la catalizzazione fisiologica da tampone INS. Biochimica et Biophysica Acta, 797, 276-287.
- Vandelli, m.A., Rivas, f., Guerra, p., Forni, f., Arletti, r. 2001. Microsfere gelatina reticolata con d, l-gliceceraldeide come potenziale sistema di consegna di Draug: preparazione, caratterizzazione, studi in vitro e in vivo. International Journal of Pharmaceutics, 215, 175-184.
- Weber, a.L. 1987. Il modello di trosa: gliceraldeide come fonte di energia e monomeri per le reazioni di condensazione prebiotica. Origins of Life, 17, 107-19.
- « Caratteristiche erithro, struttura, funzioni
- Caratteristiche della serina, funzioni, metabolismo, cibo »

