Caratteristiche della serina, funzioni, metabolismo, cibo
- 4491
- 125
- Ruth Cattaneo
IL Serina È uno dei 22 aminoacidi di base, sebbene questo non sia classificato come un aminoacido essenziale per l'uomo e altri animali, poiché è sintetizzato dal corpo umano.
Secondo la nomenclatura delle tre -letter, la serina è descritta in letteratura come (S nel codice di singola lettera). Questo aminoacido partecipa a un gran numero di rotte metaboliche e ha caratteristiche polari, ma non ha un carico a pH neutro.
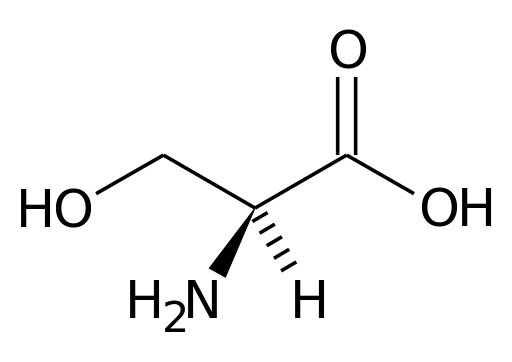
 Rappresentazione della serie dell'amminoacido serina (fonte: PageZero su di esso.Wikipedia [dominio pubblico] via Wikimedia Commons)
Rappresentazione della serie dell'amminoacido serina (fonte: PageZero su di esso.Wikipedia [dominio pubblico] via Wikimedia Commons) Molti enzimi importanti per le cellule hanno molti.
La serina, tra molte delle sue funzioni, partecipa come precursore e molecola di impalcature nella biosintesi di altri aminoacidi come la glicina e la cisteina e fa parte della struttura degli sfingolipidi presenti nelle membrane cellulari nelle membrane cellulari.
Il tasso di sintesi della serina varia in ciascun organo e, inoltre, cambia in base allo stadio di sviluppo in cui è l'individuo.
Gli scienziati hanno proposto che le concentrazioni di L-serina nel tessuto cerebrale aumentino con l'età, poiché la permeabilità della barriera delle cellule ematiche diminuisce nel cervello dell'adulto, essendo in grado di causare gravi disturbi cerebrali.
È noto che L-serina è vitale per la biosintesi di neurotrasmettitori, fosfolipidi e altre macromolecole complesse, poiché fornisce i precursori per questi molteplici percorsi metabolici.
Vari studi hanno dimostrato che la fornitura di integratori o concentrati di L-serina a determinati tipi di pazienti migliorano l'omeostasi del glucosio, la funzione mitocondriale e riducono la morte neuronale.
[TOC]
Caratteristiche e struttura
Tutti gli aminoacidi hanno come struttura di base un gruppo carbossilico e un gruppo amminico attaccato allo stesso atomo di carbonio; Tuttavia, questi differiscono l'uno dall'altro dalle loro catene laterali, note come gruppi R, che possono variare nelle loro dimensioni, struttura e persino nella loro carica elettrica
La serina contiene tre atomi di carbonio: un carbonio centrale unito, da un lato, a un gruppo carbossilico (COOH) e dall'altro, un gruppo amminico (NH3+). Gli altri due legami di carbonio centrali sono occupati da un atomo di idrogeno e da un gruppo CH2OH (gruppo R), caratteristico della serina.
Il carbonio centrale a cui i gruppi amino e carbossilici degli aminoacidi sono noti come α Carbon. Gli altri atomi di carbonio dei gruppi R sono designati con le lettere dell'alfabeto greco.
Nel caso della serina, ad esempio, l'unico atomo di carbonio nel suo gruppo R, collegato al gruppo OH, è noto come carbonio γ.
Può servirti: fosfatidilserina: struttura, sintesi, funzioni, posizioneClassificazione
La serina è classificata all'interno del gruppo di aminoacidi polari senza carico. I membri di questo gruppo sono aminoacidi molto solubili in acqua, cioè sono composti idrofili. Nella serina e nella treonina, l'idrofilia è dovuta alla sua capacità di formare ponti idrogeno con acqua attraverso i suoi gruppi idrossilici (OH).
All'interno del gruppo di aminoacidi polari senza carico, cisteina, asparagina e glutammina sono anche raggruppati. Tutti questi hanno un gruppo polare nella loro catena R, tuttavia, questo gruppo non è ionizzabile e il pH vicino alla neutralità annulla le loro cariche producendo un composto sotto forma di "Zwitterion".
Stereochimica
L'asimmetria generale degli aminoacidi rende la stereochimica di questi composti di vitale importanza nelle rotte metaboliche a cui partecipano. Nel caso della serina, questo può essere trovato come d-o-serino, essendo quest'ultimo sintetizzato esclusivamente dalle cellule del sistema nervoso noto come astrociti.
I carboni α degli aminoacidi sono carboni chirali, poiché hanno quattro diversi sostituenti uniti, il che genera che ci sono almeno due stereoisomeri distinti per ogni aminoacido.
Uno stereoisomero è un'immagine speculare di una molecola, cioè non si può sovrapporre l'uno sull'altro. Le soluzioni di questi aminoacidi ruotano il piano leggero polarizzato in direzioni opposte in direzioni opposte sono indicate con la lettera d o che sperimentalmente.
La l-serina sintetizzata nelle cellule del sistema nervoso funge da substrato per sintetizzare la glicina o la serina D. La d-serin è uno degli elementi più importanti per lo scambio di vescicole tra i neuroni, quindi alcuni autori propongono che entrambe le isoforme di serina siano, in realtà, aminoacidi essenziali per i neuroni per i neuroni.
Funzioni
Il gruppo OH della serina nella sua catena R lo rende un buon nucleofilo, quindi è la chiave per l'attività di molti enzimi con serina nei suoi siti attivi. La serina è uno dei substrati necessari per la sintesi nucleotidica NADPH e glutationici.
La serie L è indispensabile per lo sviluppo e il corretto funzionamento del sistema nervoso centrale. Gli studi hanno dimostrato che l'approvvigionamento esogeno di l-serina a basse dosi ai neuroni dell'ippocampo e alle cellule di Purkinje In vitro, Migliora la tua sopravvivenza.
Diversi studi su cellule tumorali e linfociti hanno scoperto che sono necessarie unità di carbonio dipendenti dalla serina per l'eccessiva produzione di nucleotidi, nonché per la successiva proliferazione delle cellule tumorali.
Può servirti: microbiota: composizione, funzioni e dove si trovaLa selenocisteina fa parte dei 22 aminoacidi di base ed è ottenuto solo come derivato della serina. Questo aminoacido è stato osservato solo in alcune proteine, contiene selenio anziché zolfo attaccato alla cisteina ed è sintetizzato in base a una serina steritiva.
Biosintesi
La serina è un aminoacido non essenziale, poiché è sintetizzata dal corpo umano. Tuttavia, ciò può essere assimilato dalla dieta di diverse fonti come proteine e fosfolipidi, principalmente.
La serina è sintetizzata nella sua forma dalla conversione di una molecola di glicina, una reazione mediata da un enzima idrossimetil-transferasi.
È noto che il luogo principale della sintesi di L-serina è negli astrociti e non nei neuroni. Sono queste cellule, la sintesi si verifica mediante una via di fosforilazione in cui partecipa il 3-fosfoglicerato, un intermediario glicolitico.
Tre enzimi agiscono su questa via: la deidrogenasi 3-fosfoglicerata, la fosfoserina-transferasi e la fosfoserina-fosfatasi.
Altri organi importanti per quanto riguarda la sintesi di serina sono il fegato, i reni, i testicoli e la milza. Gli enzimi che sintetizzano la serina.
Una delle prime rotte di sintesi della serina che era nota era la via catabolica coinvolta nella gluconeogenesi, in cui la serina L è ottenuta come metabolita secondario. Tuttavia, il contributo di questo percorso alla produzione di serina del corpo è basso.
Metabolismo
Attualmente è noto che la serina può essere ottenuta dal metabolismo dei carboidrati nel fegato, dove vengono prodotti l'acido D-glicerico, l'acido 3-fosfoglicerico e l'acido 3-fosfoidroxipirúvic. Grazie a un processo di transaminazione tra acido piruvico 3-idrossi e alanina viene prodotto serina.
Esperimenti con i ratti che segnavano radioattivamente il carbonio 4 del glucosio, hanno concluso che questo carbonio è effettivamente incorporato negli scheletri di carbonio della serina, suggerendo che quell'amminoacido ha un precursore di tre carboni probabilmente dal piruvato.
Nei batteri, l'enzima L-serina-desaminasi è l'enzima principale incaricato di metabolizzare la serina: converte L-serina in un piruvato. È noto che questo enzima è presente e attivo nelle colture di E. coli Concedere in media minimi con glucosio.
In questi microrganismi non è noto per certo qual è la vera funzione della l-serina-desaminasi, poiché la sua espressione è indotta da effettori mutazionali che danneggiano il DNA dalle radiazioni ultraviolette, a causa della presenza di nalidíxico, mitomicina e altri altri, quindi ne consegue che deve avere importanti implicazioni fisiologiche.
Può servirti: dryopithecus: scoperta, caratteristiche, cranio, ciboCibi ricchi di serine
Tutti gli alimenti con alte concentrazioni di proteine sono ricchi di serina, principalmente uova, carni e pesce. Tuttavia, questo è un aminoacido non essenziale, quindi non è strettamente necessario ingerzzarlo, in considerazione del fatto che il corpo è in grado di sintetizzarlo da solo.
Alcune persone soffrono di un disturbo insolito, poiché hanno un fenotipo di carenza rispetto ai meccanismi di sintesi di serina e glicina, quindi devono ingerire integratori alimentari concentrati per entrambi gli aminoacidi.
Inoltre, i marchi commerciali si specializzano nella vendita di integratori di vitamina (Lamberts, ora Sport e Holomega) offrono fosfatidilserina e concentrati di L-serina per aumentare la produzione di massa muscolare in atleti e sollevatori di pesi ad alta concorrenza.
Malattie correlate
Il malfunzionamento degli enzimi coinvolti nella biosintesi della serina può causare gravi patologie. Diminendo la concentrazione di serina nel plasma nel sangue e nel liquido cerebrospinale, può causare ipertonia, ritardo psicomotorio, microcefalia, epilessia e disturbi complessi del sistema nervoso centrale.
È stato attualmente scoperto che la carenza di serina è coinvolta nello sviluppo del diabete mellito, poiché la l-serina è necessaria per la sintesi dell'insulina e quella dei suoi recettori.
I bambini che presentano difetti nella biosintesi serina sono neurologicamente anormali alla nascita, hanno ritardi nella crescita intrauterina, microcefalia congenita, cataratta, convulsioni e un grave ritardo nello sviluppo neurologico.
Riferimenti
- Elsila, j. E., Dworkin, J. P., Bernstein, m. P., Martin, m. P., & Sandford, s. A. (2007). Meccanismi di formazione di aminoacidi negli analoghi del ghiaccio interstellare. The Astrophysical Journal, 660 (1), 911.
- Ichord, r. N., & Bearden, D. R. (2017). Encefalopatie metaboliche perinatali. Nella neurologia pediatrica dello Swaiman (PP. 171-177). Elsevier.
- Falet, j. P., Genitore, a. T., Wolosker, h., Brady, r. O., Linden, d. J., Ferris, c. D.,... & Snyder, s. H. (2000). D-Serine è un ligando endogeno per il sito della glicina del ricevitore N-metil-D-Aparte. Atti della National Academy of Sciences, 97 (9), 4926-4931
- Nelson, d. L., Lechinger, a. L., & Cox, m. M. (2008). Principi di biochimica Lechinger. Macmillan.
- Rodríguez, a. E., Ducker, g. S., Billingham, l. K., Martinez, c. A., Mainfifi, n., Suri, v.,... & Chandel, N. S. (2019). Il metabolismo della serina supporta la produzione di macrofagi IL-1β. Metabolismo cellulare, 29 (4), 1003-1011.
- Tabatabaie, l., Klomp, l. W., Berger, r., & Koning, t. J. (2010). Sintesi a L-serina nel sistema nervoso centrale: una revisione sui disturbi della carenza di serina. Genetica molecolare e metabolismo, 99 (3), 256-262.
- « Struttura di gliceraldeide, caratteristiche, funzioni
- Storia di zinco, proprietà, struttura, rischi, usi »

