Struttura di fosfato in alluminio (ALPO4), proprietà, ottenimento, usi

- 1082
- 240
- Ruth Cattaneo
Lui Fosfato in alluminio È un solido inorganico formato da uno ione in alluminio al3+ e uno ione fosfato Po43-. La sua formula chimica è Alpo4. È un solido bianco la cui struttura cristallina è simile a quella di silice siO2. È insolubile in acqua.
Può essere ottenuto da allumina (a2O3) e acido fosforico (H3Po4). Può anche essere ottenuto in base a soluzioni acquose di cloruro di alluminio (ALCL3) e fosfato di sodio (NA3Po4).
 Fosfato di alluminio ALPO4. Ondřej mangl [dominio pubblico]. Fonte: Wikimedia Commons.
Fosfato di alluminio ALPO4. Ondřej mangl [dominio pubblico]. Fonte: Wikimedia Commons. Il fosfato in alluminio ha un punto di fusione molto elevato, quindi è ampiamente usato come componente della ceramica refrattaria, cioè ceramiche che sopportano temperature molto elevate.
È anche usato come antiacido per lo stomaco, nelle miscele per la riparazione dei denti e come adiuvante dei vaccini, cioè per stimolare la risposta immunitaria dell'organismo.
Alcuni cemento refrattario hanno Alpo4 Nella sua composizione, che aumenta le proprietà meccaniche e di supporto delle alte temperature di questo tipo di cemento.
È stato usato come scudo protettivo per prevenire i materiali combustibili come determinati polimeri.
[TOC]
Struttura
L'Alpo4 È formato da un catione in alluminio al3+ e un anione fosfato Po43-.
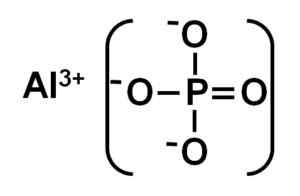 Struttura ionica del fosfato di alluminio. Autore: Marilú Stea.
Struttura ionica del fosfato di alluminio. Autore: Marilú Stea. Il fosfato di alluminio cristallino è anche chiamato fase berlinite o alfa (α-alpo4) e i suoi cristalli sono simili al quarzo.
 Cristalli di berlinite sintetici (α-alpo4). DmGualtieri [CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons.
Cristalli di berlinite sintetici (α-alpo4). DmGualtieri [CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons. La fase alfa del fosfato di alluminio è un solido formato da una rete covalente di po tetraedri4 e Alpo4 che alternati e sono uniti dagli atomi di ossigeno.
Questa struttura è isomorfa con silice, cioè ha la stessa forma di quella del SIO2.
Nomenclatura
- Fosfato in alluminio
- Monofosfato in alluminio
- Sale in alluminio acido fosforico.
Proprietà
Stato fisico
Solido bianco cristallino.
Peso molecolare
121,93 g/mol
Punto di fusione
1800 ºC
Densità
2,56 g/cm3
Solubilità
Insolubile in acqua
Altre proprietà
La struttura ALPO4 È molto simile a quello della silice sio2, Quindi condivide molte proprietà fisiche e chimiche di questo.
Può servirti: acqua disciplinataIl fosfato in alluminio è un materiale altamente refrattario, cioè resiste a temperature molto elevate senza cambiare le sue condizioni fisiche o la sua struttura e senza decomposizione.
L'Alpo4 Cristallino o berlinite quando viene riscaldato, diventa una struttura di tipo di thundimite e quindi tipo cristobalite, altre forme di questo composto che lo assomigliano al siol sio2.
 Fosfato in alluminio. ChemicalIrrest [dominio pubblico]. Fonte: Wikimedia Commons.
Fosfato in alluminio. ChemicalIrrest [dominio pubblico]. Fonte: Wikimedia Commons. Ottenimento
Fosfato di alluminio ALPO4 Può essere ottenuto mediante reazione tra acido fosforico H3Po4 e allumina al2O3. È richiesta l'applicazione di temperatura, ad esempio tra 100 e 150 ° C.
Al2O3 + 2 h3Po4 = 2 Alpo4 + 3 h2O
Può anche essere ottenuto unendo a una soluzione acquosa di cloruro di alluminio Alcl3 con una soluzione acquosa di sodio fosfato Na3Po4:
Alcl3 + N / a3Po4 = Alpo4 + 3 Nacl
Usa in ceramica
Fosfato di alluminio ALPO4 Si trova spesso nella costituzione della ceramica di allumina.
La ceramica con alto contenuto di allumina è uno dei materiali utilizzati nelle applicazioni in cui è necessario resistere a carichi elevati e condizioni gravi.
Questo tipo di ceramica è resistente alla corrosione, ad ambienti ad alta temperatura, alla presenza di vapore caldo o in atmosfere riducenti come il monossido di carbonio (CO).
Le ceramiche di allumina hanno anche una bassa conduttività elettrica e termica, quindi viene utilizzata per produrre mattoni refrattari e componenti isolanti dell'elettricità.
 Rivestimento in mattoni refrattari che può contenere alpoo in alluminio fosfato4. Questi mattoni proteggono dalle alte temperature. Alexknight12 [CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons.
Rivestimento in mattoni refrattari che può contenere alpoo in alluminio fosfato4. Questi mattoni proteggono dalle alte temperature. Alexknight12 [CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons. Perché il fosfato di alluminio è formato a una temperatura molto più bassa di SIO silice2, La sua produzione è più economica, che costituisce un vantaggio nella produzione di ceramiche appropriate ai servizi esigenti.
Produzione in ceramica fosfato in alluminio
L'allumina è abituata a2O3 e acido fosforico H3Po4 In mezzo acquoso.
La formazione preferita PH è 2-8, in quanto vi è abbondanza di specie di acido fosforico disciolto, come H2Po4- e HPO42-. Una concentrazione di ioni acidi a3+ È alto, dalla dissoluzione dell'allumina al2O3.
Può servirti: tetracloruro di carbonio (CCL4)In primo luogo, un gel di triidrogeno di difarrogeno in alluminio alh hidratato3(Po4)2.H2O:
Al3+ + H2Po4- + HPO42- + H2O ⇔ alh3(Po4)3.H2O
Tuttavia, arriva un momento in cui il pH della soluzione bassa e diventa neutrale, in cui allumina al2O3 presenta una bassa solubilità. In questo momento l'allumina insolubile forma uno strato sulla superficie delle particelle che impediscono alla reazione di continuare.
Pertanto è necessario aumentare la solubilità dell'allumina e questo si ottiene senza intoppi. Riscaldando a 150 ° C il gel continua la reazione con l'allumina al2O3 rilasciando acqua e forma la berlini cristallina (Alpha-alpo4).
Al2O3 + 2 Alh3(Po4)3.H2O → Alpo4 + 4 h2O
Si formano berlinita che si unisce a particelle e ceramiche individuali.
Altri usi
L'Alpo4 È usato come antiacido, come adsorbente, come setaccio molecolare, come il supporto del catalizzatore e come rivestimento per migliorare la resistenza alla corrosione calda. Ecco altre applicazioni.
Nell'ottenere il cemento
Il fosfato in alluminio è un ingrediente di refrattario o calcestruzzo resistente al calore.
Fornisce eccellenti proprietà meccaniche e rifrattanti a questi calcestruzzo, come la resistenza al calore. Nell'intervallo di temperatura tra 1400-1600 ° C il calcestruzzo cellulare basato sul fosfato di alluminio è uno dei materiali più efficienti come l'isolatore termico.
Non richiede l'essiccazione, il suo indurimento è ottenuto da una reazione esotermica auto -propagata. È possibile preparare i mattoni di questo materiale in qualsiasi forma e dimensione.
In cementi dentali
Il fosfato di alluminio fa parte di cementi dentali o materiali utilizzati per curare la protesi carinata.
Nei cementi dentali L'allumina viene utilizzata come moderatore delle reazioni a base di acido, in cui l'effetto moderatore è dovuto alla formazione di fosfato di alluminio sulle particelle di altri materiali.
Questi cementi hanno una resistenza di compressione e tensione molto elevata, dovuta alla presenza di fosfato di alluminio.
 I cementi dentali usati per curare la carie possono contenere fosfato in alluminio. Autore: Gerber Challenge. Fonte: Pixabay.
I cementi dentali usati per curare la carie possono contenere fosfato in alluminio. Autore: Gerber Challenge. Fonte: Pixabay. Nei vaccini
L'Alpo4 È stato usato per molti anni in diversi vaccini umani per migliorare la risposta immunitaria del corpo. Si dice che Alpo4 È un "adiuvante" di vaccini. Il meccanismo non è ancora compreso.
Può servirti: cloruro di litio (LICL): proprietà, rischi e usiÈ noto che l'effetto immunostimolante di Alpo4 Dipende dal processo di adsorbimento dell'antigene all'adiuvante, cioè dal modo in cui aderisce a questo. Un antigene è un composto che quando si entra nel corpo genera la formazione di anticorpi per combattere una malattia specifica.
Gli antigeni possono essere adsorbiti ad ALPO4 mediante interazioni elettrostatiche o mediante legame con i ligandi. Adsorb sulla superficie dell'adiuvante.
Si ritiene inoltre che le dimensioni delle particelle di ALPO4 Ha anche influenza. Una dimensione delle particelle più bassa La risposta anticorpale è più grande e più resistente.
 I vaccini possono contenere alpoo in alluminio fosfato4 Per aumentare la sua efficacia. Autore: Tumisu. Fonte: Pixabay.
I vaccini possono contenere alpoo in alluminio fosfato4 Per aumentare la sua efficacia. Autore: Tumisu. Fonte: Pixabay. Come ritardante di fiamma polimerica
L'Alpo4 È stato usato come ignari ed evitare la combustione o bruciata da alcuni polimeri.
L'aggiunta di Alpo4 a un polimero di polipropilene che ha già un ritardatore di fiamma provoca un effetto sinergico tra i due ritardanti, il che significa che l'effetto è molto maggiore di quello di entrambi gli ignari per separati.
Quando il polimero è sottoposto a combustione o bruciato in presenza di ALPO4, Si forma un metafosfato di alluminio che penetra nella superficie carbonizzata e riempie i pori e le crepe di questo.
Ciò porta alla formazione di uno scudo protettivo altamente efficiente per evitare la combustione o la combustione del polimero. In altre parole l'Alpo4 sigillare la superficie carbonizzata e impedisce al polimero di bruciare.
 Con l'Alpo4 La combustione di alcuni polimeri può essere ritardata. Autore: Hans Braxmeier. Fonte: Pixabay.
Con l'Alpo4 La combustione di alcuni polimeri può essere ritardata. Autore: Hans Braxmeier. Fonte: Pixabay. Riferimenti
- Abyzov, v.A. (2016). Calcestruzzo refrattario leggero basato sul legante in alluminio-magnesio-fosfato. Proceding Engineering 150 (2016) 1440-1445. Recuperato da ScienceDirect.com.
- Wagh, a.S. (2016). Ceramica fosfato in alluminio. In ceramica fosfato chimicamente legata (seconda edizione). Capitolo 11. Recuperato da ScienceDirect.com.
- Mei, c. et al. (2019). VACCINA DI ALLUMINO Fosfato Attjuvant: analisi della composizione e delle dimensioni dell'uso di strumenti off-line e in linea. Comput struct biotechnol j. 2019; 17: 1184-1194. NCBI recuperato.Nlm.NIH.Gov.
- Qin, Z. et al. (2019). Effetto barriera sinergica del fosfato di alluminio sul polipropilene ritardante di fiamma a base sul sistema di polifosfato di ammonio/dipentarititolo. Materiali e design 181 (2019) 107913. Recuperato da ScienceDirect.com.
- Vrieling, h. et al. (2019). Nanaparticelle di fosfato in alluminio stabilizzate usate come vaccino atjuvante. Colloidi e superfici B: Biointerfaces 181 (2019) 648-656. Recuperato da ScienceDirect.com.
- Schaefer, c. (2007). Farmaci gastrointestinali. Antiacidi. Nelle droghe durante la gravidanza e l'allattamento (seconda edizione). Recuperato da ScienceDirect.com.
- Rouquerol, f. et al. (1999). Proprietà degli adsorbenti romanzi di SOM. In adsorbimento da parte di centrali e solidi porosi. Recuperato da ScienceDirect.com.
- « Notazione ha sviluppato ciò che è, esempi ed esercizi
- Origine afro -colombia, storia, caratteristiche, importanza »

