Struttura del fluoro al litio, proprietà, ottenimento, usi

- 3014
- 800
- Enzo De Angelis
Lui Fluoruro di litio È un solido inorganico la cui formula chimica è Life. È formato da li ioni+ e f- che sono uniti attraverso un legame ionico. Si trova in piccole quantità in diversi minerali, in particolare silicati come lepidolite, acqua di mare e in molti pozzi minerali.
Ha avuto un ampio uso sui dispositivi ottici a causa della sua trasparenza in una vasta gamma di lunghezze d'onda, dallo spettro a infrarossi (IR) all'ultravioletto UV, attraverso il visibile.
 Lepidolite, minerale che contiene piccole quantità di fluoruro di vita. Rob Lavinsky, Irocks.Com-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons.
Lepidolite, minerale che contiene piccole quantità di fluoruro di vita. Rob Lavinsky, Irocks.Com-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons. È stato anche utilizzato sui dispositivi per rilevare radiazioni pericolose nei lavori in cui le persone sono esposte a questi per un breve periodo. Inoltre, viene utilizzato come materiale per sciogliere l'alluminio o per creare bicchieri o bicchieri e manifatturiero in ceramica.
Funge da materiale per coprire i componenti delle batterie al litio e per evitare la perdita iniziale del carico di questi.
[TOC]
Struttura
Il fluoro al litio è un composto ionico, cioè, formato dall'unione della litio+ e l'anione f-. La forza che li tiene insieme è elettrostatica e si chiama legame ionico.
Quando il litio viene combinato, dà un elettrone al fluoruro, entrambi essendo più stabili della via iniziale, come spiegato di seguito.
L'elemento al litio ha la seguente configurazione elettronica: [he] 1s2 2s1 E quando dà un elettrone la struttura elettronica è così: [lui] 1s2 che è molto più stabile.
L'elemento fluoro la cui configurazione elettronica è: [ne] 1s2 2s2 2 p5, Accettando l'elettrone è la forma [ne] 1s2 2s2 2 p6, più stabile.
Nomenclatura
- Fluoruro di litio
- Fluorolitio
Può servirti: ossidi non metallici- Litio monofluoruro
Proprietà
Stato fisico
Solido bianco, che cristallizza nella struttura cubica, come NaCl di cloruro di sodio.
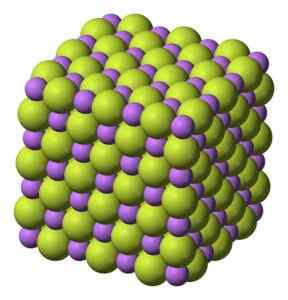 Struttura cubica di cristalli di fluoruro di litio Lif. Benjah-BMM27 [dominio pubblico]. Fonte: Wikimedia Commons.
Struttura cubica di cristalli di fluoruro di litio Lif. Benjah-BMM27 [dominio pubblico]. Fonte: Wikimedia Commons. Peso molecolare
26 g/mol
Punto di fusione
848.2 ºC
Punto di ebollizione
1673 ºC, sebbene sia volatilizzato a 1100-1200 ºC
Densità
2.640 g/cm3
Indice di rifrazione
1.3915
Solubilità
Piccolo solubile in acqua: 0,27 g/100 g di acqua a 18 ºC; 0,134 g/100 g a 25 ºC. Solubile in mezzo acido. Insolubile in alcol.
Altre proprietà
I suoi vapori hanno una specie dimica (LIF)2 e Trimeric (LIF)3. Con acido fluorhorico HF forma lihf litio2; Con idrossido di litio forma un doppio sale Lif.Lioh.
Ottenimento e posizione
Il fluoruro di litio LIF può essere ottenuto mediante reazione tra acido fluorrotto HF e idrossido di litio Lioh o litio carbonato2Co3.
Tuttavia, è presente in piccole quantità in alcuni minerali come lepidolite e acqua di mare.
 Il fluoro al litio si trova in piccole quantità in acqua di mare. Adeeb Atwan [CC di 3.0 (https: // creativeCommons.Org/licenze/di/3.0)]. Fonte: Wikimedia Commons.
Il fluoro al litio si trova in piccole quantità in acqua di mare. Adeeb Atwan [CC di 3.0 (https: // creativeCommons.Org/licenze/di/3.0)]. Fonte: Wikimedia Commons. Applicazioni
In applicazioni ottiche
La durata di LIF è usata sotto forma di cristalli compatti negli spettrofotometri a infrarossi (IR) a causa dell'eccellente dispersione che hanno nell'intervallo di lunghezza d'onda tra 4000 e 1600 cm-1.
I cristalli LIF sono ottenuti da soluzioni sature da questo sale. Può sostituire i cristalli di fluorite naturali in vari tipi di dispositivi ottici.
I cristalli grandi e puri sono usati nei sistemi ottici per i monocromatici Ultraviolet Light (UV), Visible e IR e X-Ray (0,03-0,38 nm).
 Crystal fluororo di vita vita, all'interno di un becher. V1adis1av [dominio pubblico]. Fonte: Wikimedia Commons.
Crystal fluororo di vita vita, all'interno di un becher. V1adis1av [dominio pubblico]. Fonte: Wikimedia Commons. Viene anche usato come materiale di rivestimento ottico per la regione UV a causa della sua ampia banda ottica, maggiore di quella di altri fluoruri metallici.
Può servirti: metalli alkalinotherrousLa sua trasparenza nella distanza UV (90-200 nm) lo rende ideale come rivestimento protettivo negli specchi di alluminio (AL). Gli specchi LIF/AL hanno utilizzato nei sistemi di telescopi ottici per applicazioni spaziali.
Questi rivestimenti sono ottenuti mediante deposizione fisica di deposizione di vapore e strato a livello atomico.
In rilevatori di radiazioni ionizzanti o pericolosi
Il fluoruro di litio è stato ampiamente utilizzato nei rilevatori termoluminescenti per fotoni, neutroni e β (beta).
I rilevatori termoluminescenti mantengono l'energia delle radiazioni quando esposti a questo. Successivamente quando si riscaldano, rilasciare l'energia immagazzinata in forma di luce.
Per questa applicazione, la vita è generalmente datata con impurità di magnesio (mg) e titanio (TI). Queste impurità generano alcuni livelli di energia che fungono da buchi in cui gli elettroni rilasciati dalle radiazioni sono intrappolati. Quando il materiale è quindi riscaldato, questi elettroni tornano al loro stato energetico originale che emette la luce.
L'intensità della luce emessa dipende direttamente dall'energia assorbita dal materiale.
I rilevatori termoluminescenti di LIF sono stati testati con successo per misurare complessi campi di radiazioni, come quelli presenti nel grande Hadron Collider o LHC (per il suo acronimo per l'inglese Large Hadron Collider), situato nell'Organizzazione europea per la ricerca nucleare, nota come CERN (per il suo acronimo di francese Conseil Européen versa la richerchere nucleaire).
Radiazioni nelle esperienze condotte in quel centro di ricerca presente hadrones, neutroni ed elettroni/positroni, tra gli altri tipi di particelle subatomiche, che possono essere rilevate con la vita.
Come materiale per prelittare il catodo della batteria al litio
La vita è stata testata con successo sotto forma di nanocompositi con cobalto (CO) e ferro (fede) come materiali per la preliziazione (traduzione dell'inglese Prelitopolitismo) del materiale del catodo a batteria al litio -ion.
Può servirti: etere etilicoDurante il primo ciclo di carico o fase di formazione di una batteria a ioni di litio, l'elettrolita organico viene scomposto per formare una fase solida sulla superficie dell'anodo.
Questo processo consuma litio del catodo e riduce l'energia tra il 5 e il 20% della capacità totale della batteria a ioni di litio.
Per questo motivo, è stata studiata la preliziazione elettrochimica del catodo, che genera un'estrazione elettrochimica del litio dei nanocoposti, che agisce da donatore di litio, evitando così il consumo di litio del catodo.
I nanocompositi LIF/CO e LIF/Fe hanno un'alta capacità di donare litio al catodo, essendo facile da sintetizzare, stabile in condizioni ambientali e di elaborazione della batteria.
 Batteria agli ioni di litio. Autore: MR.ちゅら さん. Lithium_Battery * Fotography Day, agosto 2005 * Persona fotografica Aney. Fonte: Wikimedia Commons.
Batteria agli ioni di litio. Autore: MR.ちゅら さん. Lithium_Battery * Fotography Day, agosto 2005 * Persona fotografica Aney. Fonte: Wikimedia Commons. In diversi usi
Il fluoruro di litio viene utilizzato come misuratore di saldatura, in particolare in alluminio, e nei rivestimenti a canna di saldatura. Viene anche usato nelle cellule di riduzione dell'alluminio.
È ampiamente utilizzato nella produzione di vetro (come quelli delle lenti) in cui il coefficiente di espansione diminuisce. Viene anche utilizzato nella produzione di ceramiche. Inoltre, è utilizzato nella produzione di smalti e vernici vitree.
Il LIF è un componente del carburante per razzi e carburanti per alcuni tipi di reattori.
La LIF è utilizzata anche nella luce che emette diodi o componenti fotovoltaici, per l'iniezione di elettroni in strati interni.
Riferimenti
- Cotone, f. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- O.S. Biblioteca nazionale di medicina. (2019). Litio di fluoro. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov.
- Obryk, b. et al. (2008). La risposta di diversi tipi di rilevatori di fluoro al litio TL a campi di radiazione misti ad alta anergia. Misurazioni delle radiazioni 43 (2008) 1144-1148. Recuperato da ScienceDirect.com.
- Sole, e. et al. (2016). Nella sintesi chimica situale di fluoruro di litio/nanocomposito metallico per prelitino ad alta capacità dei catodi. Nano Letters 2016, 16, 2, 1497-1501. Recuperato dai pub.sindrome coronarica acuta.org.
- Hennessy, J. e Nikzad, s. (2018). Deposizione di strati atomici di rivestimenti ottici al fluoro di litio per l'ultravioletto. Inorganics 2018, 6, 46. MDPI si è ripreso.com.
- « 10 esperimenti scientifici per il secondario fisico, chimica, biologia
- Struttura dell'acido metilmalonico, proprietà, sintesi, usi »

