Struttura e funzioni di flagelina
- 976
- 107
- Lino Lombardi
IL Flagelina È una proteina del filamento, che è una struttura che fa parte del flagello dei batteri. La stragrande maggioranza dei batteri ha solo un tipo di flagello. Tuttavia, alcuni ne hanno più di due.
La dimensione molecolare di questa proteina varia tra 30 kDa e 60 kDa. Ad esempio, negli enterobatteri la sua dimensione molecolare è grande, mentre in alcuni batteri di sweetcuícolas è piccolo.
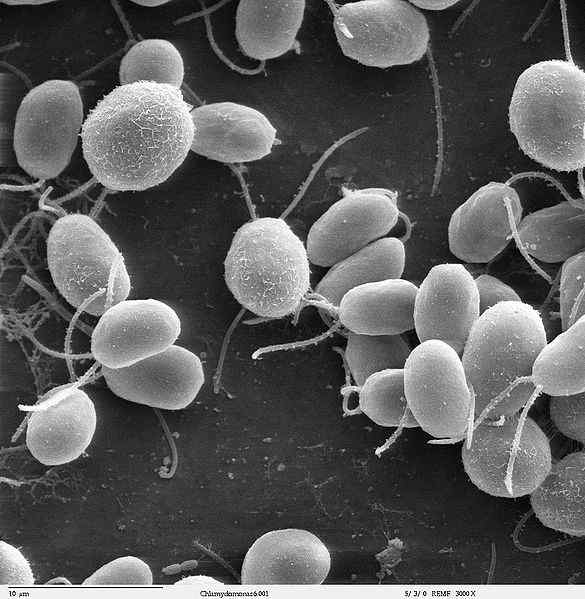
 Fonte: Dartmouth Electron Microscopy Facility, Dartmouth College [Dominio pubblico]
Fonte: Dartmouth Electron Microscopy Facility, Dartmouth College [Dominio pubblico] Flagelina è un fattore di virulenza che consente l'adesione e l'invasione per ospitare le cellule. Inoltre, è un potente attivatore di molti tipi di cellule coinvolte nella risposta immunitaria innata e adattiva.
[TOC]
Flagelo e mobilità ultrastruttura
Il flagello è ancorata alla superficie cellulare. È costituito da tre parti: 1) il filamento, che si estende dalla superficie della cellula ed è una struttura cilindrica cattiva e rigida; 2) il corpo basale, che è incorporato nelle pareti della membrana murale e cellulare, formando diversi anelli; e 3) il gancio, una struttura corta curva che si unisce al corpo basale al filamento.
Il corpo basale è la parte più complessa del flagello. Nei batteri Gram negativi ha quattro anelli collegati a una colonna centrale. Nei grammi positivi ha due anelli. Il movimento rotazionale del flagello si verifica nel corpo basale.
La posizione del flagello sulla superficie dei batteri varia ampiamente tra gli organismi, essendo in grado di essere: 1) monrico, con un solo flagello; 2) polare, con due o più; o 3) peritro, con molti flagelli laterali. Ci sono anche endoflagelos, come negli spirochete, che si trovano nello spazio perplapsmico.
Helicobacter pylori È molto mobile perché ha da sei a otto flagelli unipolari. Un gradiente di pH attraverso il muco consente H. Pylori Oriente e stabilire in un'area adiacente alle cellule epiteliali. Pseudomonas Ha un flagello polare, che presenta una chimica per gli zuccheri ed è associato alla virulenza.
Struttura di flageline
Una caratteristica della sequenza di proteine chiacchiere è che le sue regioni N-terminale e C-terminale sono altamente conservate, mentre la regione centrale è altamente variabile tra specie e sottospecie dello stesso genere. Questa ipervariabilità è responsabile di centinaia di sierotipi di Salmonella spp.
Può servirti: Serratia marcescensLe molecole di flagelina interagiscono tra loro attraverso le regioni terminali e polimerizzano un filamento. In questo, le regioni terminali sono all'interno della struttura cilindrica del filamento, mentre il centro è esposto.
A differenza dei filamenti di tubulina che vengono depolimerizzati in assenza di sali, i batteri sono molto stabili in acqua. Circa 20.000 subunità di tubulina formano un filamento.
Nel filamento di H. Pylori E Pseudomonas aeruginosa Due tipi di flagello e flab sono polimerizzati, codificati dal gene FLIC. I FLAA sono eterogenei e sono suddivisi in diversi sottogruppi, con masse molecolari che variano tra 45 e 52 kDa. Il flab è omogeneo con una massa molecolare di 53 kDa.
Spesso i residui di lisina flagelin sono metilati. Inoltre, ci sono altre modifiche come la glicezione FLAA e la fosforilazione dei rifiuti di tirosina flab, le cui funzioni sono, rispettivamente, la virulenza e il segnale di esportazione.
Crescita del filamento flagery nei batteri
Il flagello dei batteri può essere sperimentato sperimentalmente, essendo possibile per studiare la sua rigenerazione. Le subunità di flagelina vengono trasportate attraverso la regione interna di questa struttura. Quando raggiungono la fine, le subunità si stanno aggiungendo spontaneamente con l'aiuto di una proteina ("proteina Cap") chiamata HAP2 o FLOID.
La sintesi del filamento avviene attraverso la propria assemblea; Cioè, la polimerizzazione del flagello non richiede enzimi o fattori.
Le informazioni per l'assemblea del filamento si trovano nella stessa subunità. Pertanto, le subunità di flagelina polimerizzano formando undici protofilamenti, che ne formano uno completo.
Sintesi di flagelina di P. Aeruginosa E Proteus mirabilis È inibito da antibiotici come eritromicina, claritromicina e azitromicina.
Flagelina come attivatore del sistema immunitario
I primi studi hanno dimostrato che il flagello, a concentrazioni subnomolari, da Salmonella, È un potente induttore di citochine in una linea cellulare promocieta.
Può servirti: zoosporeSuccessivamente, è stato dimostrato che l'induzione della risposta proinfiammatoria implica un'interazione tra il flagello e i recettori di superficie delle cellule del sistema immunitario innate.
I recettori di superficie che interagiscono con la flagelina sono quelli di tipo Toll-5 (TLR5). Successivamente, gli studi con flagello ricombinante hanno mostrato che, quando mancava della regione ipervariabile, non è stato in grado di indurre una risposta immunitaria.
TLR5 sono presenti nelle cellule del sistema immunitario, come linfociti, neutrofili, monociti, macrofagi, cellule dendritiche, cellule epiteliali e noduli linfatici. Nell'intestino, TLR5 regola la composizione del microbiota.
I batteri Gram negativi in genere usano il sistema secretorio di tipo III per traslocare il flagello al citoplasma delle cellule ospiti, che innesca una serie di eventi intracellulari. Pertanto, la flageline nell'ambiente intracellulare è riconosciuta dalle proteine della famiglia NAIP (un inibitore della famiglia Apoptosi/NLR).
Successivamente, il complesso Flagelina-Naip5/6 interagisce con il ricevitore del tipo NOD, che genera la risposta dell'host a infezione e danno.
Flagelina e piante
Le piante riconoscono questa proteina tramite Rilevamento 2 del flagello (FLS2). Quest'ultimo è un recettore della chinasi nelle ripetizioni di leucina ed è una controparte di TLR5. FLS ”interagisce con la regione N-terminale di LA Flagelina.
L'unione di flagelin a FLS2 produce fosforilazione della Map Kinase Road, che culmina con la sintesi di proteine che mediano la protezione contro l'infezione fungina e i batteri.
In alcune piante di solanáceas, il flagello può anche unirsi al recettore FLS3. In questo modo, questi sono protetti da agenti patogeni che sfuggono alla difesa mediata da FLS2.
Flagelina come adiuvante
Un adiuvante è un materiale che aumenta la cellula o la risposta umorale a un antigene. Poiché molti vaccini producono una scarsa risposta immunitaria, è necessario avere buoni adiuvanti.
Può servirti: batteri eterotrofi: caratteristiche ed esempi di specieNumerosi studi hanno dimostrato l'efficacia del flagello come adiuvante. Queste indagini consistevano nell'uso della flagelina ricombinante nei vaccini, valutata dai modelli animali. Tuttavia, questa proteina è ancora superata dalla fase I degli studi clinici.
Tra le flagelinas ricombinanti studiate ci sono: flagelina-epitope 1 di ematoglutinina del virus dell'influenza; Flagelina-epitope Schistosoma mansoni; Calore stabile a flageline per riscaldare E. coli; Flagelina -proteína 1 della superficie di Plasmodium; e flagelina-proteina del virus del Nilo avvolgimento, tra gli altri ricombinanti.
Ci sono alcuni vantaggi di usare il flagelin come adiuvante nei vaccini per uso umano. Questi vantaggi sono i seguenti:
1) È efficace a dosi molto basse.
2) Non stimolano la risposta IGE.
3) È possibile inserire la sequenza di un altro adiuvante, AG, nella sequenza di flagelli senza influire sul segnale di flageline tramite TLR5.
Altri usi del flagelin
Poiché i geni di flagelina presentano un'ampia variazione, può essere utilizzato per eseguire rilevamenti specifici o ottenere l'identificazione di specie o ceppi.
Ad esempio, la combinazione di PCR/RFLP è stata utilizzata per studiare la distribuzione e il polimorfismo dei geni di flageline in isolati E. coli dal Nord America.
Riferimenti
- Hajam, io. A., Dar, p. A., Shahnawaz, io., Jaume, J. C., Leggi, j. H. 2017. Flallino batterico: un agente immunomodulatore di potenza. Medicina sperimentale e molecolare, 49, E373.
- Kawamura-Sato, K., Inuma, e., Hasegawa, t., Horii, t., Yamashino, t., Ohta, m. 2000. Effetto delle concentrazioni di subinhibitory di macrolidi sull'espressione della flamellina in Pseudomonas aeruginosa E Proteus mirabilis. Agenti antimicrobici e chemioterapia, 44: 2869-2872.
- Mizel, s. B., Bates, j. T. 2010. Flallino come attjuvant: meccanismi cellulari e potenziale. Journal of Immunology, 185, 5677-5682.
- Prescott, l. M., Harley, J. P., Klain, s. D. 2002. Microbiologia. MC Graw-Hill, New York.
- Schaechter, m. 2009. La scrivania eniclopedia della microbiologia. Academic Press, San Diego.
- Winstanley, c., Morgan, a. W. 1997. Il gene della flamellina batterica come biomarcatore per la rilevazione, la genetica della popolazione e l'analisi epidemiologica. Microbiologia, 143, 3071-3084.
- « Caratteristiche e classificazione dei parazoa
- Caratteristiche della parete cellulare batterica, biosintesi, funzioni »

