Struttura dei filamenti intermedi, tipi, funzioni
- 3762
- 1162
- Rosolino Santoro
IL filamenti intermedi, Noto anche in letteratura come "IFS" (dall'inglese Filami intermedi), sono una famiglia di proteine fibrose citosoliche insolubili presenti in tutte le cellule eucariotiche multicellulari.
Fanno parte del citoscheletro, che è una rete filamentosa intracellulare che è principalmente responsabile del supporto della struttura cellulare e di vari processi metabolici e fisiologici come il trasporto di vescicole, movimento e spostamento cellulare, ecc.
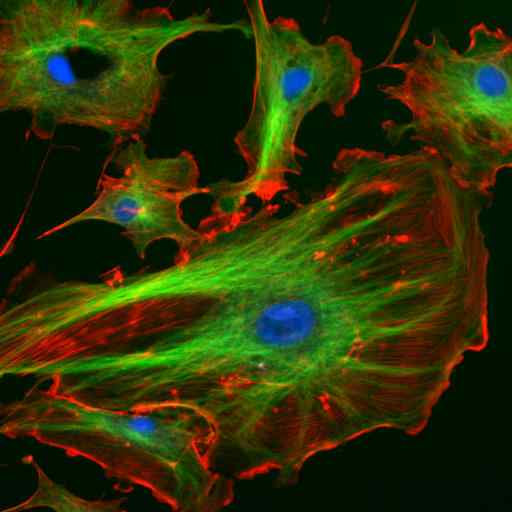
 Microscopia mediante immunofluorescenza di due proteine dei filamenti intermedi degli astrociti (Vimina e GFAP) (fonte: Gerryshaw [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] via Wikimedia Commons)
Microscopia mediante immunofluorescenza di due proteine dei filamenti intermedi degli astrociti (Vimina e GFAP) (fonte: Gerryshaw [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] via Wikimedia Commons) Insieme a microtubuli e microfilamenti, i filamenti intermedi partecipano all'organizzazione spaziale degli organelli intracellulari, nei processi di endocitosi e esocitosi e anche nei processi della divisione cellulare e della comunicazione intercellulare.
I primi filamenti intermedi che furono studiati e descritti furono le cheratine, uno dei primi tipi di proteine la cui struttura fu analizzata dalla diffrazione di raggi X negli anni '30.
Il concetto di filamenti intermedi, tuttavia, è stato introdotto negli anni '80 da Lazarides, che li ha descritti come "integratori meccanici dello spazio cellulare", caratterizzati dalla loro insolubilità e dalla loro capacità di rientrare In vitro Dopo la sua denaturazione.
Molti autori sono considerati gli elementi di "ammortizzazione" dello stress per le cellule animali, poiché sono filamenti più flessibili rispetto ai microtubuli e ai microfilamenti. Non solo si trovano nel citoscheletro, ma fanno anche parte del nucleoesqueleto.
A differenza degli altri componenti fibrosi del citoscheletro, i filamenti intermedi non partecipano direttamente ai processi di mobilità cellulare, ma funzionano nel mantenimento strutturale e nella resistenza meccanica delle cellule.
[TOC]
Struttura
 Fonte: http: // RSB.Informazioni.NIH.Gov/ij/immagini/[dominio pubblico]
Fonte: http: // RSB.Informazioni.NIH.Gov/ij/immagini/[dominio pubblico] I filamenti intermedi hanno un diametro approssimativo di 10 nm, caratteristica strutturale con cui sono stati nominati, poiché le loro dimensioni sono tra le dimensioni corrispondenti ai filamenti di miosina e actina, che sono rispettivamente di circa 25 nm e 7 nm.
Differiscono strutturalmente dagli altri due tipi di filamenti di citoscheletro, che sono polimeri delle proteine globular.
Tutte le proteine che costituiscono i filamenti intermedi hanno un'organizzazione molecolare simile, che è costituita da un dominio α-e-e-e-e-e-e-e-e-elicida o "corda" che ha quantità diverse di segmenti di "formatori a bobina" della stessa dimensione.
Questo dominio elicoidale è affiancato da una "testa" non terminale e da una "coda" non ipoidale all'estremità C-terminale, ed entrambi variano sia in sequenza di dimensioni che aminoacidi.
All'interno della sequenza di questi due estremi ci sono le ragioni di consenso che sono comuni per i 6 tipi di filamenti intermedi noti.
Nei vertebrati, il dominio "corda" della proteina dei filamenti citosolici intermedi ha circa 310 rifiuti di aminoacidi, mentre le proteine citosoliche degli invertebrati e il laminato nucleare hanno circa 350 aminoacidi di lunghezza.
Può servirti: rettili: cosa sono, caratteristiche, classificazione, riproduzioneAssemblaggio
I filamenti intermedi sono strutture "autoassemblaggio" che non hanno attività enzimatica, che le differenzia anche dalle loro controparti citoscheletriche (microtubuli e microfilamenti).
Queste strutture sono inizialmente assemblate come tetrameri di proteine filamentose che le comprendono sotto l'influenza di soli cationi monovalenti.
Questi tetrameri sono lunghi 62 nm e i loro monomeri sono associati lateralmente per formare le "unità di lunghezza" (UFL, inglese Film di longola unitaria), Ciò che è noto come la fase 1 dell'assemblaggio, che si verifica molto rapidamente.
Gli UFL sono i precursori dei lunghi filamenti e, poiché i dimeri che li comprendono si legano a vicenda in un modo di antiparalle e sfalsati, queste unità hanno un dominio centrale con due domini fiancheggiati attraverso i quali si verifica la fase 2 dell'allungamento, in cui si verifica l'Unione longitudinale di altri UFL è dato.
Durante quello che è stato chiamato come fase 3 dell'assemblaggio, si verifica la compattazione radiale del diametro dei filamenti, che produce i filamenti intermedi maturi di più o meno 10 nm di diametro.
Funzioni
Le funzioni dei filamenti intermedi dipendono considerevolmente dal tipo di cellula che viene considerata e, nel caso degli animali (inclusi gli esseri umani), la loro espressione è regolata in modo specifico del tessuto, quindi dipende anche dal tipo di tessuto che in studio.
Epiteli, muscoli, mesenchimale e gliali e neuroni hanno diversi tipi di filamenti, specializzati in base alla funzione delle cellule a cui appartengono.
Tra queste funzioni, i più importanti sono il mantenimento strutturale delle cellule e la resistenza a diverse stress meccanici, poiché queste strutture hanno una certa elasticità che consente loro di smorzare diversi tipi di forze imposte sulle cellule.
Tipi di filamenti intermedi
Le proteine che costituiscono filamenti intermedi appartengono a una famiglia grande ed eterogenea di proteine filamentose che sono chimicamente diverse ma si distinguono in sei classi in base alla loro omologia delle sequenze (I, II, III, IV, V e VI).
Sebbene non sia molto comune, diversi tipi di cellule, in condizioni molto particolari (sviluppo, trasformazione cellulare, crescita, ecc.) Possono co-espressi più di una classe di filamenti intermedi che formano proteine
Classe I e II di filamenti intermedi: acido e cheratine di base
Le cheratine rappresentano la maggior parte delle proteine dei filamenti intermedi e, nell'uomo, rappresentano più di tre quarti dei filamenti intermedi.
Hanno pesi molecolari che variano tra 40 e 70 kDa e differiscono dalle altre proteine del filamento intermedio a causa del loro alto contenuto nella glicina e nella serina.
Può servirti: ricci: caratteristiche, habitat, riproduzione, ciboSono conosciuti come acidi e cheratine di base per i loro punti isoelettrici, che sono tra 4.9 e 5.4 per cheratine acide e tra 6.1 e 7.8 per le basi.
In queste due classi circa 30 proteine sono state descritte e sono presenti soprattutto nelle cellule epiteliali, in cui entrambi i tipi di proteina "co-poolimerizzano" e formano filamenti composti.
Molte del caso I cheratine di filamenti intermedi si trovano in strutture come capelli, chiodi, corna, picchi e artigli, mentre la classe II sono le più abbondanti in citosol.
Classe III di filamenti intermedi: proteine di tipo demina/vimentina
Le cadute sono una proteina acida di 53 kDa che, a seconda del suo grado di fosforilazione, ha varianti diverse.
Alcuni autori hanno anche chiamato i filamenti della caduta come "filamenti intermedi muscolari", poiché la loro presenza è abbastanza limitata, sebbene in piccole quantità, tutti i tipi di cellule muscolari.
In miofibrille, le cadute si trovano nella linea Z, quindi si pensa che questa proteina contribuisca alle funzioni contrattili delle fibre muscolari quando si lavora nell'unione di miofibrillas e membrana plasmatica.
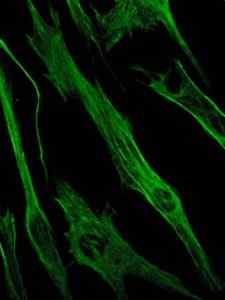 Fotografia della colorazione della proteina di vimentina, una proteina dei filamenti intermedi delle cellule epiteliali ed embrionali (fonte: Vikoriia kosach [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] via Wikimedia Commons)
Fotografia della colorazione della proteina di vimentina, una proteina dei filamenti intermedi delle cellule epiteliali ed embrionali (fonte: Vikoriia kosach [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] via Wikimedia Commons) A sua volta, la vimentina è una proteina presente nelle cellule mesenchimali. I filamenti intermedi formati da questa proteina sono flessibili ed è stato determinato che resistono a molti dei cambiamenti conformazionali che si verificano durante il ciclo cellulare.
Si trova nei fibroblasti, nelle cellule muscolari lisce, nei globuli bianchi e in altre cellule del sistema circolatorio animale.
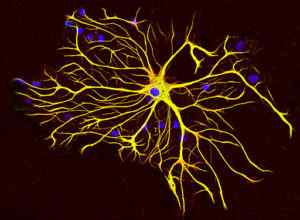
Classe IV di filamenti intermedi: proteine neurofilamentose
Conosciuto anche come "neurofilamenti", questo tipo di filamenti intermedi include uno degli elementi strutturali fondamentali di assoni e dendriti neuronali; Sono spesso associati ai microtubuli che compongono anche queste strutture.
I neurofilamenti degli animali vertebrati sono stati isolati, determinando che si tratta di una tripletta proteica da 200, 150 e 68 kDa che partecipano all'assemblaggio In vitro.
Differiscono da altri filamenti intermedi in cui hanno braccia laterali come "appendici" che sono proiettati dalla loro periferia e che lavorano nell'interazione tra filamenti vicini e altre strutture.
Le cellule gliali producono un tipo speciale di filamenti intermedi noti come filamenti intermedi gliali, che differiscono strutturalmente dai neurofilamenti, poiché sono composti da una singola proteina da 51 kDa e che ha proprietà fisico diverse.
Classe V di filamenti intermedi: filamenti di lamina nucleare
Tutti i fogli che fanno parte del nucleoesqueleto sono in realtà proteine del filamento intermedio. Questi hanno un peso molecolare tra 60 e 75 kDa e si trovano nei nuclei di tutte le cellule eucariotiche.
Può servirti: Trichuris TrichiuraSono essenziali per l'organizzazione interna delle regioni nucleari e per molte delle funzioni di questo organello essenziale per l'esistenza di eucarioti.
Classe VI di filamenti intermedi: Nestino
Questo tipo di filamenti intermedi pesa più o meno 200 kDa ed è prevalentemente nelle cellule staminali del sistema nervoso centrale. Sono espressi durante lo sviluppo neuronale.
Patologie correlate
Ci sono più malattie negli esseri umani che si riferiscono a filamenti intermedi.
In alcuni tipi di cancro come melanomi maligni o carcinomi al seno, ad esempio, la co-espressione di filamenti intermedi di vimentina e cheratina portano alla differenziazione o all'interconversione delle cellule epiteliali e mesenchimali.
È stato dimostrato sperimentalmente che questo fenomeno aumenta l'attività migratoria e invasiva delle cellule tumorali, che ha importanti implicazioni nei processi metastatici caratteristici di questa condizione.
Eriksson e collaboratori (2009) esaminano i diversi tipi di malattie e la loro relazione con mutazioni specifiche nei geni coinvolti nella formazione dei sei tipi di filamenti intermedi.
Le malattie relative alle mutazioni geniche codificanti per i due tipi di cheratina sono l'epidermolisi del bulast, l'ipercheratosi epidermolitica, la distrofia corneale, cheratodermie e molti altri.
I filamenti intermedi di tipo III sono coinvolti in numerose cardiomiopatie e diverse malattie muscolari relative principalmente alle distrofie. Inoltre, sono anche responsabili della cataratta dominante e di alcuni tipi di sclerosi.
Numerose sindromi e disturbi neurologici sono correlati ai filamenti di tipo IV, come Parkinson Parkinson. Allo stesso modo, i difetti genetici nei filamenti di tipo V e VI sono responsabili dello sviluppo di diverse malattie autosomiche e correlati al funzionamento del nucleo cellulare.
Esempio di questi sono la sindrome della progeria di Hutchinson-Gilford, la distrofia muscolare Emery-Dreifuss, tra gli altri.
Riferimenti
- Anderton, b. H. (1981). Filamles intermedi: una famiglia di strutture omologhe. Journal of Muscle Research and Cell Motility, 2(2), 141-166.
- Eriksson, J. E., Palari, h., Robert, d., Eriksson, J. E., Dechat, t., Grin, b.,... Goldman, R. D. (2009). Presentazione di filamori intermedi: dalla scoperta alla malattia. The Journal of Clinical Investigation, 119(7), 1763-1771.
- Fuchs, e., & Weber, K. (1994). Filamles intermedi: struttura, dinamica, funzione e malattia. Annu. Rev. Biochimico., 63, 345-382.
- Hendrix, m. J. C., Seftor, e. A., Chu, e. W., Trevor, k. T., & Seftor, R. E. B. (millenovecentonovantasei). Ruolo delle riempimenti intermedi in migrazione, invasione e metastasi. Recensioni di cancro e metastasi, quindici(4), 507-525.
- Herrmann, h., & Aebi, u. (2004). Filami intermedi: struttura molecolare, meccanismo di assemblaggio e integrazione in impalcature funzionalmente intracellulari distinte. Revisione annuale della biochimica, 73(1), 749-789.
- Herrmann, h., & Aebi, u. (2016). Filamles intermedi: struttura e assemblaggio. Prospettive di Cold Spring Harbor in biologia, 8, 1-22.
- McLean, i., & Lane, B. (1995). Filamori intermedi in Diew. Opinione attuale in biologia cellulare, 7(1), 118-125.
- Steinert, p., & Roop, D. (1988). Biologia molecolare e cellulare dei film intermedi. Revisione annuale della biochimica, 57(1), 593-625.
- Steinert, p., Jones, J., & Goldman, R. (1984). Filami intermedi. The Journal of Cell Biology, 99(1), 1-6.
- « Caratteristiche gastrotriche, habitat, riproduzione, cibo
- Caratteristiche della moschea morbida, tassonomia, habitat, usi »

