Fattore di imballaggio

- 3377
- 242
- Enzo De Angelis
Il fattore di imballaggio è una frazione che indica quanto volume occupano le particelle, che siano atomi, ioni o molecole, nello spazio interno di un cristallo. Il suo valore è sempre inferiore a 1, che diventa il 100% del volume del vetro; Più esattamente, la sua cellula unitaria, che è la più piccola rappresentazione dell'intero vetro.
Un fattore di imballaggio al 100% significa che le particelle occupano il volume della cellula unitaria nella sua interezza. Fisicamente è impossibile che ciò accada, perché implicherebbe, ad esempio, che gli atomi deformino le loro radio e si dissolino come se fossero un "liquido elettronico". La geometria degli atomi, sferica per comodità, si traduce sempre in spazi vuoti durante l'imballaggio.
 Come accade nelle dolci macchine di erogazione, il fattore di imballaggio ci dice quanto siano "strette" le particelle di un cristallo: più è più grande, più gomma o atomi, ci saranno nello spazio
Come accade nelle dolci macchine di erogazione, il fattore di imballaggio ci dice quanto siano "strette" le particelle di un cristallo: più è più grande, più gomma o atomi, ci saranno nello spazio Nella definizione del fattore di imballaggio si presume che gli atomi siano costituiti da sfere rigide, come gomme o palline di caramelle di una macchina dispensata (immagine superiore). Tra le sfere ci saranno sempre spazi cavi in cui le sfere più piccole (impurità o additivi possono essere sgattaiolati).
Se aumentiamo il fattore di imballaggio, le sfere verranno schiacciate, trasformando il vetro più compatto e denso; o d'altra parte, più deformabile, come con i metalli malleabili e duttili.
Il fattore di imballaggio si applica per qualsiasi tipo di vetro. Tuttavia, il suo calcolo può diventare un po 'noioso, quindi sarà considerato solo per i cristalli atomici con strutture semplici.
[TOC]
Formula del fattore di imballaggio
Il fattore di imballaggio è generalmente espresso in percentuale. Ad esempio, se il suo valore è del 40%, significa che le particelle occupano a malapena il 40% dello spazio totale della cella unitaria; o cosa è lo stesso di affermare che il 60% del vetro è "vuoto".
Quanto sopra chiarisce qual è la formula per il calcolo di questo fattore:
- Ugly = (Volume di atomi)/ (volume di celle unitarie)
Dove significa brutto Fattore di imballaggio atomico, Quali sono i cristalli più semplici.
Il volume della cella unita. Gli atomi, d'altra parte, sono quelli che definiscono la cellula, quindi è possibile esprimere le dimensioni delle stesse dalle radio atomiche, come si vedrà nelle prossime sezioni.
Può servirti: mix racemico: chiralità, esempiPer quanto riguarda il volume degli atomi, il numero totale di essi presente nella cella unitaria (1, 2, 3, ecc.), così come la sua geometria sferica. Pertanto, la formula viene modificata un po ':
Ugly = (atomi nº) (volume dell'atomo)/ (volume di celle unitarie)
Per calcolare brutto, devi determinare allora Noatomo e vCellula unitaria.
Semplice cubico
 Semplice cella cubica. Fonte: ccc_crystal_cell_ (opaque).Svg: *cobique_centre_atomes_par_maille.SVG: Cdang (Idea originale ed Esecuzione SVG), Samuel Dupré (Odeeling 3D con SolidWorks) Deriva lavoro: Daniele Pugliesi (talk) Deriva lavoro: Daniele Pugliesi, CC BY-SA 3.0, via Wikimedia Commons
Semplice cella cubica. Fonte: ccc_crystal_cell_ (opaque).Svg: *cobique_centre_atomes_par_maille.SVG: Cdang (Idea originale ed Esecuzione SVG), Samuel Dupré (Odeeling 3D con SolidWorks) Deriva lavoro: Daniele Pugliesi (talk) Deriva lavoro: Daniele Pugliesi, CC BY-SA 3.0, via Wikimedia Commons La cellula unitaria più semplice di tutte è la semplice cubica. In esso abbiamo alcune porzioni di atomi in ciascuno degli angoli. Se vediamo, noteremo che la lunghezza A Da questa cellula è uguale a 2R, poiché sono gli atomi che definiscono la cellula. Quindi, il volume della cella unitaria sarà uguale a:
VCellula unitaria = A3 (Volume di un cubo)
= (2R)3
= 8r3
Nel frattempo, il volume dell'atomo sarà uguale a:
Vatomo = (4/3) πr3 (volume di una sfera)
Ognuno degli angoli è condiviso da altre 8 celle di unità vicine. Pertanto, abbiamo una frazione 1/8 in ogni angolo e ne avete 8, non ci importa 1 atomo per unità di cella (1/8 x 8 = 1).
Il fattore di imballaggio è:
Ugly = (1) (4/3) πr3 /8r3
= π/6 ≈ 52%
Cioè, in una semplice cellula cubica gli atomi occupano il 52% dell'intero volume di vetro.
Cubico centrato nel corpo
Determinazione del volume cellulare
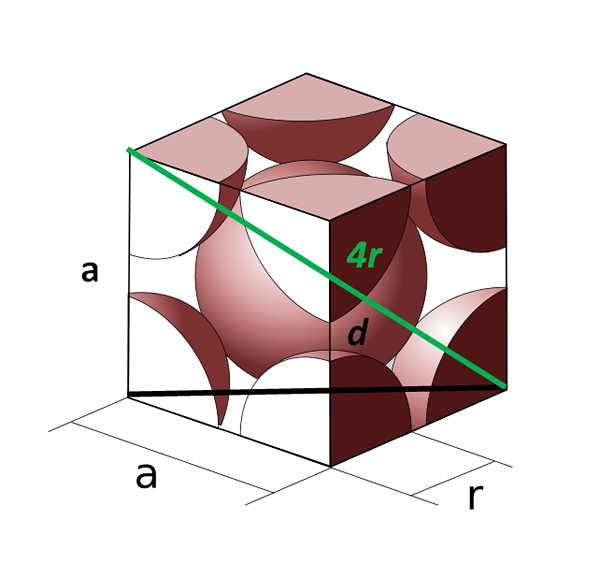 Corpo unitario del corpo centrato sul corpo. Fonte: cobique_centre_atomes_par_maille.SVG: CDANG (idea originale e esecuzione SVG), Samuel Dupré (Odeeling 3D con SolidWorks) lavoro derivato: Daniele Pugliesi, CC BY-SA.0, via Wikimedia Commons
Corpo unitario del corpo centrato sul corpo. Fonte: cobique_centre_atomes_par_maille.SVG: CDANG (idea originale e esecuzione SVG), Samuel Dupré (Odeeling 3D con SolidWorks) lavoro derivato: Daniele Pugliesi, CC BY-SA.0, via Wikimedia Commons Ora vediamo la cellula cubica centrata sul corpo. Il lato A Non può essere più uguale a 2R, perché abbiamo uno spazio vuoto tra i due atomi degli angoli. C'è quindi una diagonale D uguale a 4R (colore verde) che attraversa la cella attraverso il centro e tocca gli angoli opposti e un'altra diagonale D del viso (nero).
I lati A, D e 4r disegnare un triangolo rettangolo a cui possiamo applicare la trigonometria per calcolare qual è il valore di A:
(4R)2 = d2 + A2
Può servirti: forze intermolecolariMa d'altra parte, alla base della cella unitaria abbiamo un altro triangolo (A, A E D) a cui possiamo calcolare l'ipotenusa:
D2 = a2 + A2
= 2a2
Sostituire allora avremo:
(4R)2 = (2 °2) + a2
(4R)2 = 3a2
A = (4/√3) r
La VCellula unitaria è uguale a:
VCellula unitaria = a3
= ((4/√3) r)3
Determinazione del fattore di imballaggio
Si noti che rispetto al numero di atomi abbiamo 1 atomo all'interno di questa cella, seguendo la stessa detrazione fatta per la semplice cella cubica e un altro atomo aggiuntivo che si trova al centro della cellula. Pertanto, ci sono un totale di 2 atomi per ogni cellula cubica centrata sul corpo.
Il fattore di imballaggio è quindi:
Ugly = (2) (4/3) πr3 / ((4/ √3) r)3
= (√3/8) π ≈ 68%
Cioè, in una cellula cubica focalizzata sul corpo, il 68% del volume di vetro è occupato dagli atomi. Di conseguenza, questa disposizione cristallina è più compatta (o densa) del semplice cubico.
Cubo centrato sui volti
Determinazione del volume cellulare
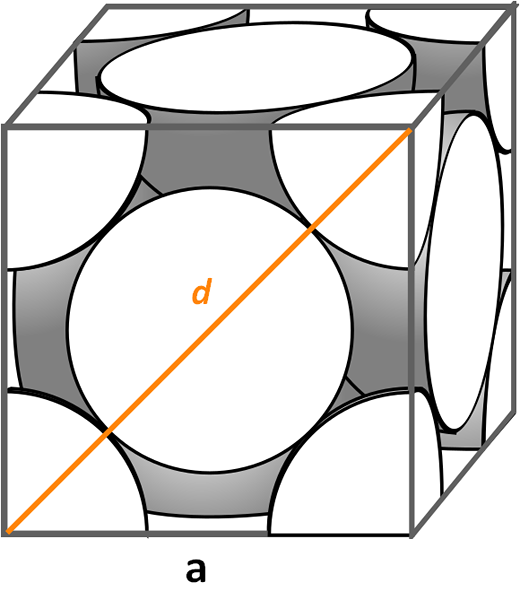 Cellula unitaria cubica centrata sui volti. Fonte: Cdang, CC BY-SA 3.0, via Wikimedia Commons
Cellula unitaria cubica centrata sui volti. Fonte: Cdang, CC BY-SA 3.0, via Wikimedia Commons Diamo un'occhiata alla cellula unitaria cubica centrata su volti, molto comune nelle sinfine di sali inorganici e alcuni metalli, come oro e argento. Per determinare il suo fattore di imballaggio, dobbiamo iniziare, seguendo gli esempi precedenti, per trovare quale sia il volume della sua cella unitaria. È necessario calcolare di nuovo il lato A E così il volume del cubo A3.
Questa volta la procedura è più semplice e più diretta, perché abbiamo una diagonale D Davanti a quello, insieme ai lati A, Formano un triangolo destro a cui possiamo applicare la trigonometria:
D2 = a2 + A2
= 2a2
Compimento A avremo:
A = D/√2
Ma lo notiamo visivamente D È uguale a 4R, quindi facciamo una sostituzione:
A = 4r/√2
= 2r 21-1/2
= (2√2) r
Essere vCellula unitaria uguale a:
A3 = ((2√2) R)3
= (16√2) r3
Per quanto riguarda il numero di atomi per cellula, abbiamo otto parti di un atomo in ogni angolo e anche una metà di atomo per ciascuno dei sei volti, che è condiviso da un'altra cellula vicina. Pertanto, il numero di atomi è uguale a:
Atomi nº = 1/8 (8) + 1/2 (6) = 1 + 3 = 4
Determinazione del fattore di imballaggio
Avendo che ci sono 4 atomi in ogni cellula cubica focalizzati sui volti, e anche sul suo volume, che è uguale a (16√2) r3, Possiamo quindi calcolare il fattore di imballaggio:
Ugly = (atomi nº) (volume dell'atomo)/ (volume di celle unitarie)
= (4) (4/3) πr3 / (16√2) r3
Può servirti: gruppo Acilo: struttura, caratteristiche, composti e derivati= π/(3√2) ≈ 74%
Si noti che questa cella è ancora più compatta di quelle precedenti: il 74% del volume totale della cellula è occupato dagli atomi. In un cristallo perfetto e puro, questo sarebbe equivalente a dire che il 26% del suo volume è disponibile per ospitare altri atomi ospiti.
Compatto esagonale
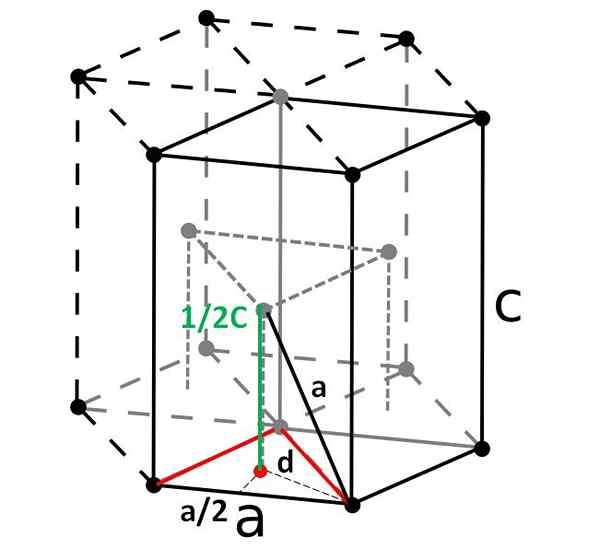 Cella esagonale compatta e la sua cellula primitiva romboedrica. Fonte: Originale: Dornelfvector: DePiep, CC BY-SA 3.0, via Wikimedia Commons
Cella esagonale compatta e la sua cellula primitiva romboedrica. Fonte: Originale: Dornelfvector: DePiep, CC BY-SA 3.0, via Wikimedia Commons Infine, tra le celle unitarie più semplici e compatte abbiamo l'essagonale compatto. A differenza dei precedenti, il calcolo del suo volume è un po 'più ingombrante. Come si può vedere, non è cubico, quindi ha due parametri A E C, Quest'ultimo è l'altezza della cella.
Determinazione dell'altezza della cella
La cellula esagonale può essere suddivisa in tre cellule romboyane e da una di esse verrà calcolata A E C. Il lato A, Sebbene non così evidente nell'immagine sopra, è uguale a 2R. Calcolare C, Invece, usiamo il triangolo e il prodotto Red Point del prisma triangolare interno della stessa cellula.
Dobbiamo calcolare la distanza D Essere in grado di determinare quanto vale C. Sul pavimento il triangolo rosso è equilatero, con un angolo di 60º. Ma se un altro triangolo rettangolo interno è considerato con i lati A/2 e D, e un angolo di 30º (metà), quindi per trigonometria possiamo determinare D:
Cos (30º) = (A/2) / D
D = A/√3
E ora consideriamo il triangolo giusto composto dai lati C/2 (verde), A (nero e D (punteggiato):
A2 = (A/√3)2 + (C/2)2
Compimento C Noi avremmo:
C = √ (8/3) A
E sostituendo A Di 2r:
C = √ (8/3) (2r)
= √ (4 · 2/3) (2R)
= 4√ (2/3) r
Determinazione del volume cellulare
Per determinare il volume della cella esagonale devi moltiplicare l'area esagonale per la sua altezza. Sapere che i triangoli equilaterali hanno lati A, La sua altezza è calcolata H. Pertanto, trovare l'area di un triangolo, che è per questo caso √3/4A2, Moltiplichiamo questo valore per 6 per ottenere l'area esagonale: 3 (√3/2)A2
Il volume è quindi:
VCellula unitaria = Area esagonale X altezza
= 3 (√3/2)A2 X 4√ (2/3) r
E sostituendo ancora una volta A Di 2r:
VCellula unitaria = 3 (√3/2) (2r)2 X 4√ (2/3) r
= 24√2 r3
Determinazione del fattore di imballaggio
Nella cellula esagonale ci sono 12 atomi negli angoli, che hanno 1/6 dei loro volumi all'interno. Ci sono anche 3 atomi interni i cui volumi sono completi e altri 2 atomi sulle facce superiori e inferiori le cui metà dei suoi volumi sono all'interno della cellula.
Pertanto, il numero di atomi è uguale a:
Atomo nº = 1/6 (12) + 1 (3) + 1/2 (2) = 6 atomi
E il fattore di imballaggio è finalmente:
Ugly = (atomi nº) (volume dell'atomo)/ (volume di celle unitarie)
= (6) (4/3) πr3 / 24√2 r3
= π/(3√2) ≈ 74%
Si noti che il fattore di compartimento per la cellula esagonale è lo stesso della cellula cubica centrata su facce. Cioè, entrambi sono ugualmente compatti.
Riferimenti
- C. Barry Carter & M. Grant Norton. (2007). Scienza e ingegneria dei materiali in ceramica. Springer.
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Wikipedia. (2021). Fattore di imballaggio atomico. Recuperato da: in.Wikipedia.org
- Brandon. (2021). Qual è il fattore di imballaggio atomico (e come calcolarlo per SC, BCC, FCC e HCP)? Studente di scienze dei materiali e ingegneria. Recuperato da: MsEstudent.com

