Struttura Europio, proprietà, ottiene, usi

- 3585
- 842
- Enzo De Angelis
Lui Europio È un elemento chimico appartenente alle terre rare, rappresentato dal simbolo chimico dell'UE e il cui nome è dovuto, evidentemente, al continente europeo. Questo è il più reattivo dei metalli delle terre rare, confrontando il litio, il calcio e il bario, motivo per cui la sua diffusione mineralogica è molto dispersa.
È uno dei metalli più rari e costosi, a causa di tutte le procedure che devono essere fatte per estrarre le impurità. Fisicamente mostra un bagliore dorato grigiastro, causato dalla sua rapida ossidazione, è appena esposto all'aria. Pertanto, raramente è possibile archiviarlo con il suo autentico colore d'argento.
 Europio ossidato. Fonte: immagini ad alta risoluzione degli elementi chimici/cc di (https: // creativeCommons.Org/licenze/di/3.0)
Europio ossidato. Fonte: immagini ad alta risoluzione degli elementi chimici/cc di (https: // creativeCommons.Org/licenze/di/3.0) L'Europio è così reattivo che deve essere immagazzinato in ampoule o contenitori sigillati in atmosfere inerte di argon. Anche immerso nell'olio minerale viene ossidato dal piccolo ossigeno disciolto.
Una caratteristica eccezionale dell'Europio è la sua luminescenza, soprattutto osservata nei suoi composti con numero di ossidazione +3, come gli Stati Uniti2O3, che è un fosforo rosso applicato negli infiniti di dispositivi elettronici e anche sui biglietti per impedire le sue falsificazioni.
[TOC]
Europio Discovery
La scoperta dell'Europio è stata creata in alcune parti, durante il diciannovesimo secolo e in diversi paesi (Svezia, Germania e Svizzera) del continente europeo. Gli ioni Europio erano difficili da identificare perché i loro spettri di assorbimento si mescolavano a quello di altri metalli delle terre rare, come Hill, Gadolinum e Lanthean, nonché il Samarium.
Pertanto, l'identificazione e l'isolamento di tutti quei metalli hanno trascinato l'Europio come impurità senza caratterizzare. Ad esempio, l'isolamento di un campione puro di Cerio, nel 1839 di Carl Gustav Mosander, aveva come prodotto il riconoscimento di altri nuovi elementi: Lantano e Didimio.
Durante lo studio del didimio e la conclusione è stato raggiunto che consisteva davvero in una miscela di altri elementi (proseodiemio e neodimio), è apparso il samario, trovato nel 1879 da Paul è ilmile Lecoq.
Può servirti: idruro di alluminio (ALH3): struttura, proprietà, usiPiù tardi, nel 1886, il chimico svizzero Jean Charles Galissard purifò campioni di samarium che trova Gadolinio. Lecoq per il 1892 aveva già studiato gli spettri di Gadolinio e quello di un altro nuovo elemento.
Quindici anni dopo, nel 1901, il chimico francese Eugène Anatole Demarcay ha finalmente isolato questo nuovo elemento e lo battezzò come Europio, in onore dell'Europa.
Struttura chimica dell'Europio
Gli atomi di Europio rimangono uniti grazie al legame metallico, partecipando ad esso gli elettroni dei loro orbitali 4F e 6S. Come risultato delle sue caratteristiche elettroniche, le radio atomiche e la modalità del suo imballaggio, l'Europio finisce per adottare una struttura cristallina cubica centrata sul corpo (BCC), essendo una delle meno dense.
Non ci sono fonti bibliografiche che menzionano un altro polimorfo per l'Europio, a parte la fase BCC, entro altri intervalli di temperatura; Ma sotto diverse pressioni.
Ad esempio, l'Europio ha presentato una pressione vicina a 18 GPA adotta una struttura esagonale compatta e infine si trasforma in una fase monoclinica a pressioni più elevate del 31.5 GPA.
Configurazione elettronica
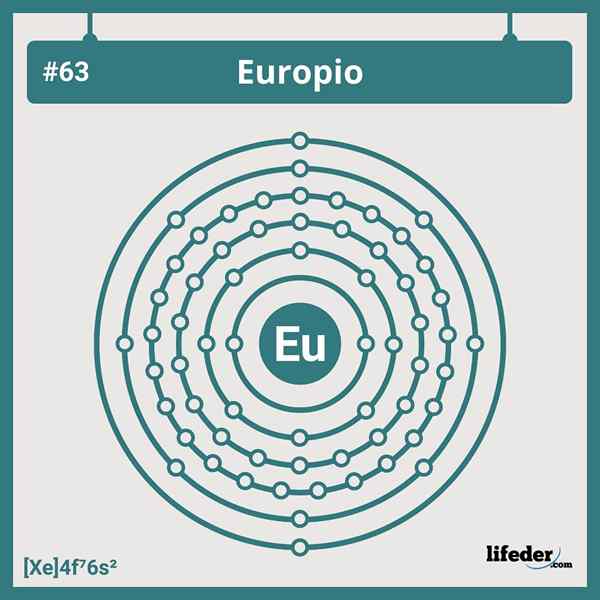 Configurazione elettronica Europium
Configurazione elettronica Europium La configurazione elettronica abbreviata dell'Europio è:
[Xe] 6s24f7
Essendo in posizione o gruppo 7 della serie Lantanide, ha sette elettroni che occupano i suoi orbitali 4F; E quindi, non corrisponde a nessuna delle deviazioni che troviamo nelle configurazioni elettroniche per gli elementi della tabella periodica.
Proprietà Europio
Aspetto fisico
Metallo bianco argento, durezza morbida simile a quella del piombo e che diventa dorato quando è esposto all'aria, coprendo uno strato di ossido e carbonato.
Numero atomico
63
Massa molare
151.96 g/mol
Punto di fusione
826 ºC
Punto di ebollizione
1529 ºC
Densità
Solido: 5.264 g/cm3
Al punto di fusione: 5.13 g/cm3
Stati di ossidazione
I principali stati di ossidazione dell'Europio sono +2 (UE2+) e +3 (UE3+), Essendo +1 (UE+) Il meno comune dei tre.
Può servirti: collegamento covalente polare: caratteristiche ed esempiEnergie di ionizzazione
-Primo: 547.1 kJ/mol (UE+ gassoso)
-Secondo: 1085 kJ/mol (UE2+ gassoso)
-Terzo: 2404 kJ/mol (UE3+ gassoso)
Elettronegatività
1.2 sulla scala Pauling.
Ordine magnetico
Paramagnetico
Reattività
La reattività dell'Europio è paragonabile a quella del litio e, quindi, è il metallo più reattivo delle terre rare. Ad esempio, reagire rapidamente con l'acqua per formare l'idrossido corrispondente, UE (OH)3, Il giallo, che a differenza degli idrossidi alcalini è insolubile in acqua:
2 UE + 6 H2O → 2 UE (OH)3 + 3 h2
Inoltre, quando brucia in un leggero ossidato negli Stati Uniti2O3 E licenziò una fiamma rossastra, che ricorda quella del litio:
4 UE + 3 O2 → 2 UE2O3
L'Europio è in grado di formare molti composti con lo stato di ossidazione di +2, perché ha i suoi orbitali F mezzo pieno (4f7), che dà al suo atomo una stabilità elettronica insolita.
Il catione europeo2+ presenta un comportamento chimico simile a quello di BA2+, Ma a differenza di quest'ultimo, funge da agente riducente moderatamente forte, ossidando gli Stati Uniti3+.
Ottenimento
Materia prima
L'Europio è presente nei minerali delle terre rare come la Bastnasita e la monazite. Tuttavia, poiché mantiene una certa somiglianza con i metalli alcalini e alcalinanti rispetto alla loro reattività, i loro ioni sono molto dispersi nella corteccia terrestre accanto a minerali di calcio o altri metalli, quindi non c'è minerale da solo che sia ricco di europio. Ecco perché il tuo ottenimento è molto costoso.
Processi
Gli ioni UE3+ Fanno parte di molti fosfati di Rust and Rare Earth. Pertanto, il primo passo è separarli dagli altri metalli presenti. Per fare ciò, i minerali vengono elaborati, in particolare il bastaggio; Vengono toccati, si dissolvono in acidi o basi forti e le precipitazioni frazionate sono sottoposte usando vari reagenti. Allo stesso modo, la cromatografia a scambio ionico viene utilizzata per separare gli Stati Uniti3+.
Quando viene elaborato il minerale, si ottiene un concentrato di ioni UE3+, che può essere ridotto usando lo zinco metallico o una sua amalgama, in modo che siano ridotti agli Stati Uniti2+. Quindi gli Stati Uniti2+ Coprecipita su carbonato o bario solfato.
Può servirti: idrogenazione cataliticaQuesto precipitato viene tenuto e subisce una separazione per ottenere l'ossido dell'UE2O3, che è ridotto con Lantano in un melting pot di Tantalio, per finalmente distillare e condensare l'Europa metallica.
Un altro metodo per ottenere l'Europio è eseguire un'elettrolisi di una miscela di EUCL3 e NaCl o CACL2 fuso. Pertanto, il gas di cloro si verifica all'anodo, mentre l'Europio metallico è formato nel catodo.
Usi/applicazioni
 La luminescenza rossastra vista in questo biglietto per l'euro, sotto una lampada UV, è dovuta a un composto Europium. Fonte: Repro di H. Grobe/CC di (https: // creativeCommons.Org/licenze/di/3.0)
La luminescenza rossastra vista in questo biglietto per l'euro, sotto una lampada UV, è dovuta a un composto Europium. Fonte: Repro di H. Grobe/CC di (https: // creativeCommons.Org/licenze/di/3.0) L'Europio nella sua forma metallica manca di usi di routine. Tuttavia, i suoi composti sono un'altra storia, in particolare il suo ossido dell'UE2O3, la cui fosforescenza è stata fatta da una componente indispensabile degli schermi su dispositivi, monitor e televisori. Questo perché è un fosforo rosso, che emette una caratteristica luce rossa.
La fosforescenza rossastra dell'Europio (III) viene anche utilizzata per impedire che i biglietti Euro siano falsificati, illuminando con la luce UV per confermare la sua legittimità.
D'altra parte, se miscelati con composti euro (ii), che sono corrispondenze bluastre, si ottiene una luce bianca, molto ricorrente nel vetro di lampade fluorescenti.
L'Europio viene aggiunto in piccole quantità per alluminare lo stronzio per preparare fosforo di colori diversi, che si distinguono per avere una fosforescenza a lungo termine.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (quarta edizione). Mc Graw Hill.
- Centro nazionale per le informazioni sulla biotecnologia. (2020). Europio. Riepilogo degli elementi pubchem. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Wikipedia. (2020). Europio. Recuperato da: in.Wikipedia.org
- I redattori di Enyclopedia Britannica. (2020). Europio. Recuperato da: Britannica.com
- R. J. Marito et al. (27 agosto 2012). Europium-IV: incommensuramente. Recuperato da: riviste.APS.org
- David. Skowron. (26 novembre 2017). A cosa è usato l'Europio? - Usi comuni e storici. Studio. Recuperato da: studio.com
- Dottore. Doug Stewart. (2020). Fatti per elementi Europium. Recuperato da: Chemicool.com
- « Origine del monoteismo, caratteristiche e religioni
- Concetto di differenze culturali ed esempi tra paesi »

