Struttura terziaria delle caratteristiche delle caratteristiche principali

- 1431
- 212
- Benedetta Rinaldi
IL Struttura terziaria delle proteine È la conformazione tridimensionale che le catene polipeptidiche acquisiscono quando si piegano su se stesse. Questa conformazione appare dalle interazioni tra le catene laterali dello spreco di aminoacidi del polipeptide. Le catene laterali possono interagire indipendentemente dalla loro posizione nella proteina.
Poiché dipende dalle interazioni tra i gruppi R, la struttura terziaria mostra aspetti non ripetitivi della catena, poiché questi gruppi sono diversi per ciascun residuo di aminoacidi. La struttura secondaria, d'altra parte, dipende da gruppi carbossilici e amminici, che sono presenti in tutti gli aminoacidi.
 Struttura terziaria della proteina della chinasi fosfatasi, con strutture secondarie in alfa e foglia beta. Preso e modificato da: A2-33. Modificato da Alejandro Porto. [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)].
Struttura terziaria della proteina della chinasi fosfatasi, con strutture secondarie in alfa e foglia beta. Preso e modificato da: A2-33. Modificato da Alejandro Porto. [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)].
Alcuni autori suggeriscono che le proteine fibrose hanno una semplice struttura terziaria, ma tuttavia, altri autori sottolineano che questa struttura è tipica delle proteine globulari.
[TOC]
Proteine fibrose
Nelle proteine fibrose, le catene polipeptidiche sono disposte sotto forma di filamenti lunghi o fogli lunghi; Sono generalmente costituiti da un tipo unico di struttura secondaria. Questa struttura secondaria è, nella maggior parte dei casi, più importante della struttura terziaria nel determinare la forma delle proteine.
La sua funzione biologica è strutturale, conferendo forza e/o elasticità agli organi e alle strutture in cui si trovano, mantenendoli insieme. Tutte le proteine fibrose sono insolubili in acqua, a causa della grande quantità di aminoacidi idrofobici che presentano.
Tra queste proteine fibrose ci sono cheratine e collagene. I primi si trovano in tessuti congiuntivi e in strutture come peli, chiodi (α-queratina), scale e piume (β-coatine). Il collagene, nel frattempo, si trova in ossa, tendini e pelle, tra gli altri.
α-Queratinas
Queste proteine fanno parte delle proteine dei filamenti intermedi così chiamati, che svolgono un ruolo importante nel citoscheletro degli organismi multicellulari. Inoltre, sono il principale componente di peli, unghie, lana, corna, zoccoli e una delle principali proteine della pelle animale.
Può servirti: colorazione KinyounLa struttura della molecola è un'elica α. Due fili di α-queratina possono essere disposti in parallelo e iscriversi uno sopra l'altro con i loro gruppi idfobici R che interagiscono tra loro. In questo modo viene creata una struttura super -ola.
La struttura terziaria della cheratina α è semplice ed è dominata dalla struttura secondaria di α-elica. D'altra parte, è presente anche la struttura quaternaria, poiché due molecole partecipano alla struttura sovrhelicoidale, che interagiscono attraverso legami non covalenti.
β-curatina
La struttura primaria è simile a quella delle α-queratina, ma la sua struttura secondaria è dominata dai fogli β. Sono il principale costituente delle scale dei rettili e delle piume degli uccelli.
Collagene
Questa proteina può rappresentare oltre il 30% della massa proteica totale di alcuni animali. Si trova in cartilagos, ossa, tendini, cornea e pelle, tra gli altri tessuti.
La struttura secondaria del collagene è unica, rappresentata da un'elica Levogira con 3,3 rifiuti di aminoacidi per ogni giro. Tre catene di eliche levogio (α).
Le molecole di tropocollagen si uniscono per formare una fibra di collagene che ha una grande resistenza, superiore all'acciaio e paragonabile con ad alta resistenza.
Altre proteine fibrose
Altri tipi di proteine fibrose sono la fibroina ed elastina. Il primo di loro è formato da fogli β, costituiti principalmente da glicina, alanina e serina.
Le catene laterali di questi aminoacidi sono piccole, quindi possono essere strettamente confezionate. Il risultato è una fibra che è sia molto resistente che molto non ancora.
Può servirti: tampone fosfato (PBS): fondazione, preparazione e usiNell'elastina, nel frattempo, la valina sostituisce la serina tra i suoi principali aminoacidi costituenti. A differenza della fibroina, l'elastina è molto estensibile, da cui il suo nome. Nella costituzione della molecola, agisce anche la lisina, che può partecipare a un collegamento incrociato che consente all'elastina di recuperare la sua forma quando la tensione cessa.
Proteine globulari
Le proteine globulari, a differenza dei fibrose, sono solubili e generalmente hanno diversi tipi di strutture secondarie. Tuttavia, in queste ci sono conformazioni tridimensionali più importanti che acquisiscono quando si piegano su se stessi (struttura terziaria).
Queste particolari conformazioni tridimensionali danno un'attività biologica specifica a ciascuna proteina. La funzione principale di queste proteine è regolatoria, come con gli enzimi.
Caratteristiche della struttura terziaria delle proteine globulari
La struttura terziaria delle proteine globulari ha alcune caratteristiche importanti:
- Le proteine globulari sono compatte grazie all'imballaggio quando la catena del polipeptide si piega.
- I rifiuti di aminoacidi distanti nella struttura primaria delle catene polipeptidiche sono vicini, essendo in grado di interagire tra loro a causa della piegatura.
- Le proteine globulari più grandi (più di 200 aminoacidi) possono avere diversi segmenti compatti, indipendenti tra loro e con funzioni particolari, e ciascuno di questi segmenti è chiamato dominio. Un dominio può avere tra 50 e 350 rifiuti di aminoacidi.
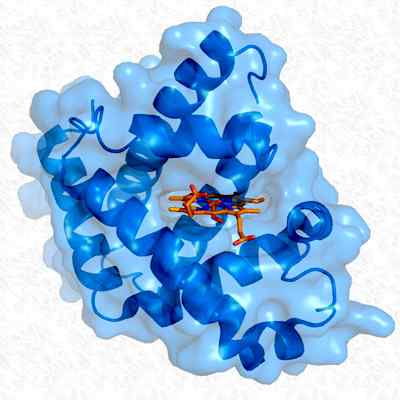 Struttura terziaria della mioglobina. Preso e modificato da: Thomas Splettstoesser. Modificato da Alejandro Porto. [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)].
Struttura terziaria della mioglobina. Preso e modificato da: Thomas Splettstoesser. Modificato da Alejandro Porto. [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)].
Regole generali della piegatura delle proteine globali
Come già notato, le proteine hanno particolari forme pieghevoli, che danno loro anche caratteristiche particolari. Questo piegatura non è casuale ed è favorita sia dalla struttura primaria che secondaria e da alcune interazioni non covalenti, e ci sono anche alcune restrizioni fisiche alla piegatura, quindi alcune regole sono state formulate:
Può servirti: organi linfoidi primari- Tutte le proteine globulari hanno definito modelli di distribuzione, con gruppi idrofobici diretti nella molecola e nei rifiuti idrofili nello strato esterno nello strato esterno. Per questo, sono richiesti almeno due strati di struttura secondaria. Il ciclo β-α-β e il vertice α-α possono contribuire con quei due strati.
- I fogli β sono generalmente disposti in una forma arrotolata a levogira.
- In una catena polipeptidica, possono verificarsi diverse curve per spostarsi da una struttura secondaria a un'altra, come le curve β o γ, che possono essere in grado di investire la direzione della catena in quattro rifiuti di aminoacidi o meno.
- Le proteine globulari hanno fogli α, β, colpi di scena e segmenti strutturati in modo irregolare.
Denaturazione delle proteine
Se una proteina perde la sua struttura tridimensionale nativa (naturale), perde la sua attività biologica e la maggior parte delle sue proprietà specifiche. Questo processo è noto come denaturazione.
La denaturazione può verificarsi quando le condizioni ambientali naturali cambiano, ad esempio per variazione o pH. Il processo è irreversibile in molte proteine; Tuttavia, altri possono recuperare spontaneamente la loro struttura naturale ripristinando le normali condizioni ambientali.
Riferimenti
- C.K. Mathews, k.E. Van Hold & K.G. Ahern (2002). Biochemery. 3a edizione. Benjamin / Cummings Publishing Company, Inc.
- R.Murray, p. Mayes, d.C. Granner & v.W. Rodwell (1996). Biochemery di Harper. Appleton & Lange.
- J.M. Berg, j.L. Tymoczko & l. Stryer (2002). Biochemery. 5a edizione. W. H. Freeman e compagnia.
- W.M. Becker, l.J. Kleinsmith e J. Hardin (2006) World of the Cell. 6a edizione. Pearson Education Inc.
- A.Lechinger (1978). Biochimica. Omega Editions, s.A.
- T. McKee e J.R. McKee (2003). Biochimica: le basi molecolari della vita. 3a edizione. The McGraw-Hiii Companies, Inc.
- « Proprietà, applicazioni ed esempi di condensa fermioniche
- Struttura del dodecil sodio solfato (SDS), proprietà, usi »

