Struttura del dodecil sodio solfato (SDS), proprietà, usi
- 5023
- 1411
- Lidia Valentini
Lui Sodio solfato dodecil (SDS), è un sale organico anionico, sintetico e anfifillico. La parte apolare e idrofobica corrisponde alla catena di idrocarburi; Mentre la parte polare e idrofila è dovuta al solfato, con carico negativo.
La SDS è un tensioattivo: le sue molecole sono posizionate sulla superficie delle soluzioni acquose, producendo una diminuzione della tensione superficiale. Questa funzione consente il suo utilizzo in shampoo, creme dentali, saponi e altri articoli di cura personale e pulizia della casa.
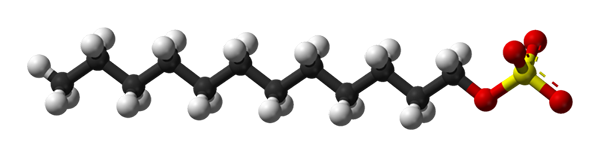
 Struttura del dodecile del solfato di sodio. Fonte: Benjah-BMM27 via Wikipedia.
Struttura del dodecile del solfato di sodio. Fonte: Benjah-BMM27 via Wikipedia. Il dodecile di solfato di sodio si lega alla proteina e produce il suo svolgimento, acquisendo una forma allungata. I gruppi di solfato sono esposti all'acqua, acquisendo proteine di carico negative, il cui numero è proporzionale al peso molecolare.
Per questo motivo, la SDS consente la determinazione dei pesi molecolari delle proteine attraverso l'elettroforesi nella poliacrilammide.
Sebbene sia stato sospettato un possibile effetto cancerogeno della SDS, non è stato in modo conclusivo dimostrato che è così. La SDS può produrre, come altri detergenti, la pelle e gli occhi irritati.
[TOC]
Struttura SDS
Nella prima immagine la molecola SDS è stata mostrata con un modello di sfere e barre. Come si può vedere, ha una coda di carbonio idrofobica e apolare (sfere in bianco e nero); E allo stesso tempo, una testa polare, grazie alla presenza del gruppo -so4- (sfere gialle e rosse).
Sebbene non sia mostrato, dovrebbe esserci una sfera viola che rappresenta la nazione nata+, proprio accanto al gruppo -so4-, interagendo elettrostaticamente.
Detto questo, è inteso ad occhio nudo perché questo composto è anfifillico; e anche una tensione anionica, poiché il carico della SDS è negativo e può attirare altri cationi oltre al NA+.
La molecola dà la falsa impressione di essere una struttura lineare rigida e immobile. Tuttavia, è tutto il contrario. La SDS potrebbe essere paragonata a un "verme", la cui coda di carbonio presenta più vibrazioni e rotazioni dei suoi semplici collegamenti. Questo lo rende in grado di adottare diverse conformazioni o pieghe nel mezzo; In acqua, per esempio.
Cristalli
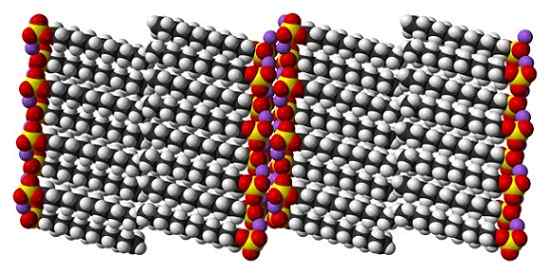 Struttura cristallina di dodecil sodio solfato. Fonte: Benjah-BMM27 [dominio pubblico]
Struttura cristallina di dodecil sodio solfato. Fonte: Benjah-BMM27 [dominio pubblico] Mentre è vero che il dodecile del solfato di sodio è una molecola dinamica, a stato solido non ha bisogno di muoversi troppo, comportandosi come una barra "semplice". E così, ogni molecola o barra sono posizionate in modo tale che le interazioni tra code carbonizzate e, allo stesso tempo, quelle dei loro carichi ionici aumentano.
Può servirti: clorito di sodio (NaClo2): struttura, proprietà, usi, rischiIl risultato è la formazione di un cristallo monoclinico, in cui le molecole SDS sono confezionate in diverse colonne a barre (immagine superiore). Le forze intermolecolari che li uniscono sono tali, che questi cristalli richiedono una temperatura di 206 ° C per sciogliere la fase liquida.
Micelle
Al di fuori del comfort dei suoi cristalli, la molecola SDS non può più rimanere ferma; Inizia a torcere la coda per aumentare o ridurre le interazioni con l'ambiente esterno.
Se questo mezzo è acqua, si verifica un fenomeno chiamato formazione di micella: le code di carbonio e idrofobiche si legano per circondarsi, mentre teste polari, gruppi -so4-, Rimangono in superficie interagendo con molecole H2O.
Quindi, la Micella acquisisce una morfologia ellissoide oblata (come la Terra, ma più schiacciata). Nel cristallo sono come blocchi a barre e in un mezzo acquoso come le micelle di ellissoide. E se il mezzo fosse olio? Il myce sarebbe stato investito: le teste polari così4- Andrebbero al nucleo, mentre le loro code gassate sarebbero state esposte al petrolio.
Proprietà
Nomi
- Sodio dodecilsulfato (SDS).
- Sodio laurilsulfato (SLS).
Formula molecolare
C12H25O4SNA.
Massa molare
288.378 g/mol.
Descrizione fisica
Diverse presentazioni: polvere secca, liquido o solido umido. I suoi cristalli hanno una colorazione bianca o cremosa.
Odore
Padre odore di sostanze grasse, toilette.
Punto di fusione
206 ºC.
Solubilità dell'acqua
1 · 105 mg/l. 1 g disciolto in 10 ml di una soluzione opalescente.
Densità
1,01 g/cm3.
Stabilità
È stabile nelle condizioni di archiviazione consigliate.
Decomposizione
Se riscaldato alla decomposizione emette un fumo bianco di ossido di zolfo e ossido di sodio.
Tensione superficiale
39,5 dynas/cm a 25 ºC.
Concentrazione molare critica
È 8,2 mm in acqua pura a 25 ° C.
Applicazioni
Cura personale e pulizia a casa
Il dodecile solfato è un tensioattivo che viene utilizzato in numerosi prodotti, come saponi da toilette, bagni di schiuma, creme di rasoio, ecc. Viene inoltre utilizzato per rimuovere le macchie da difficoltà a eliminare, nella pulizia dei pavimenti e dei bagni, peloso degli articoli della cucina, ecc.
Può servirti: olio o benzina etere: formula, struttura, usiMedicina veterinaria e umana
È usato come repellente di pulci e zecche, presente negli animali. Viene anche usato come idratante in alcuni antibiotici, per uso orale o topico.
La SDS è microbicida contro virus con avvolgimento, come l'HIV, i tipi 1 e 2 e l'herpes semplice virus dell'herpes (HSV-2). Agisce anche sul virus senza avvolgimento: papillomavirus, reovirus, rotavirus e polovirus. Tuttavia, questo uso non è approvato.
L'uso di SDS è stato suggerito come una doccia vaginale che fornisce protezione contro il virus a trasmissione sessuale. Inoltre, nella lavorazione del latte materno per eliminare o ridurre la possibilità di trasmissione dell'HIV attraverso l'allattamento al seno.
Oltre alla sua azione antivirale, la SDS agisce su batteri patogeni e funghi. SDS elimina la resistenza ai farmaci e i fattori di resistenza sessuale da E. coli; e blocca la crescita di numerosi batteri grammi positivi.
In laboratorio
La SDS si lega alle proteine che causano la loro denaturazione, fornendo carichi negativi e un cambiamento conformazionale. Ciò consente la determinazione dei suoi pesi molecolari attraverso l'elettroforesi nella poliacrilammide.
La SDS viene utilizzata anche nella preparazione di campioni di tessuto cerebrale per l'uso nella microscopia ottica. Viene anche usato nella preparazione di campioni di sangue per il numero di eritrociti.
La SDS viene utilizzata nella purificazione degli acidi nucleici, a causa della loro capacità di dissolvere le membrane e la loro azione inibitoria sull'attività degli enzimi ARNASA e DNAASA.
Inoltre, la SDS viene utilizzata nella caratterizzazione dei composti di ammonio quaternario.
Additivo alimentare
La SDS viene utilizzata come emulsionante e ispessimento alimentare. Migliora la stabilità e la consistenza dei prodotti al forno. Inoltre, viene utilizzato come ausiliario nei prodotti di uova secchi.
Può servirti: nitrato di zinco: struttura, proprietà, ottenimento, usiIndustria
La SDS viene utilizzata nel settore della galvanoplastica, in particolare nichel e zinco; come vernice emulsionante e penetrante e smodenti di pittura; Nella formulazione di esplosivi modellati dall'iniezione; e in razzi solidi come schiuma.
Rischi
L'esposizione costante SDS può causare iperplasia cutanea nelle cavie. Gli esseri di coniglio e umani sono meno sensibili a queste lesioni. Il contatto diretto con SDS ad una concentrazione ≤ 20%, può causare un'infiammazione moderata e l'irritazione della pelle.
D'altra parte, l'esposizione prolungata alla SDS può produrre dermatite, con segni di arrossamento, gonfiore e formazione.
La SDS può produrre l'irritazione degli occhi a contatto. Può anche essere molto reattivo in alcune persone e causare l'irritazione dell'inalazione del tratto respiratorio e del disagio respiratorio.
Raramente, l'ingestione di SDS può causare lesioni caustiche. Ma è stato riportato nei bambini che hanno ingerito SDS, vomito abbondante di rapido sviluppo, depressione del SNC e angoscia respiratoria.
Non sono state trovate prove di genotossicità o azione teratogena. In 242 pazienti con dermatite eczematosa, sono stati trovati 6,4 % dei pazienti con allergia, attribuibili all'uso di SDS.
Riferimenti
- Dati strutturali da l. A. Smith, r. B. Hammond, k. J. Roberts, d. Machin, g. McLeod (2000). Determinazione della roccia cristallina del dodecil solfato di sodio anidro usando una combinazione di diffrazione di polvere di radiazione di sychrotrone e tecniche di modellazione molecolare. Journal of Molecular Structure 554 (2-3): 173-182. Doi: 10.1016/S0022-2860 (00) 00666-9.
- Wikipedia. (2019). Sodio dodecil solfato. Recuperato da: in.Wikipedia.org
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Sodio dodecil solfato. Database PubChem. CID = 3423265. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Hammouda b. (2013). Effetto di temperatura sulla nanostruttura delle micelle SDS in acqua. Journal of Research del National Institute of Standards and Technology, 118, 151-167. Doi: 10.6028/jres.118.008
- Elsevier. (2019). Sodio dodecil solfato. Scienza diretta. Estratto da: ScienceDirect.com
- Kumar, s., Thejajenuo, j. K. e tsipila, t. (2014). Effetti tossicologici del dodecil solfato di sodio. Journal of Chemical and Pharmaceutical Research 6 (5): 1488 - 1492.
- Rete di dati tossicologici. (S.F.). Sodio lauril solfato. Txnet. Recuperato da: txnet.Nlm.NIH.Gov
- « Struttura terziaria delle caratteristiche delle caratteristiche principali
- Struttura di fosfatidilserina, sintesi, funzioni, posizione »

