Struttura secondaria delle proteine delle caratteristiche

- 1800
- 539
- Zelida Gatti
IL Struttura proteica secondaria È il nome che definisce la conformazione piegata localmente di alcune parti della catena del polipeptide. Questa struttura è costituita da diversi schemi che si ripetono regolarmente.
Ci sono molti modi in cui le catene delle proteine sono piegate. Tuttavia, solo alcune di queste forme sono molto stabili. In natura, le forme più frequenti che le proteine acquisiscono sono l'elica α e il foglio β. Queste strutture possono essere descritte dagli angoli di collegamento ψ (Psi), e φ (Phi) dei rifiuti di aminoacidi.
 Schema e modello di palline e aste dell'elica ALFA di proteine (struttura secondaria). Preso e curato da: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)].
Schema e modello di palline e aste dell'elica ALFA di proteine (struttura secondaria). Preso e curato da: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Le interazioni stabilite tra le catene laterali dei rifiuti di aminoacidi possono aiutare a stabilizzare o, al contrario, destabilizzare la struttura secondaria delle proteine. La struttura secondaria può essere osservata nella costituzione di molte proteine fibrose.
[TOC]
Storia
Nel decennio degli anni '30 del secolo scorso, William Atsbury, lavorando con i raggi X, ha scoperto che la proteina dei capelli, così come quella delle punte porcospin, possedevano nei loro segmenti di struttura che venivano ripetuti regolarmente.
Sulla base di questi risultati e con la conoscenza dell'importanza dei legami idrogeno nell'orientamento dei gruppi polari dei legami peptidici, William Pauling e collaboratori, di conseguenza hanno determinato ipoteticamente le possibili conformazioni regolari che le proteine potrebbero possedere.
Pauling e i suoi collaboratori, negli anni '50, stabilirono diversi postulati che dovevano essere adempiuti nei legami delle catene polipeptidiche, tra cui e in primo luogo, che due atomi non possono avvicinarsi a una distanza inferiore alla loro distanza dalla loro rispettiva radio di van der Waals.
Hanno anche indicato che sono necessari collegamenti non covalenti per stabilizzare la piegatura delle catene.
Può servirti: riproduzione sessualeSulla base di questi postulati e delle conoscenze precedenti e usando modelli molecolari, sono riusciti a descrivere alcune conformazioni regolari di proteine, tra cui, che sono state successivamente dimostrate di essere la natura più frequente, come l'elica α e lamina β β β β β.
Elica α
È la struttura secondaria più semplice, in cui la catena polipeptidica è disposta a forma arrotolata e compatta attorno a un asse immaginario. Inoltre, le catene laterali di ogni aminoacido si distinguono da questo scheletro elicoidale.
Gli aminoacidi, in questo caso, sono disposti in modo da avere angoli di collegamento ψ Da -45 ° a -50 ° e φ di -60 °. Questi angoli si riferiscono al legame tra il carbonio α e l'ossigeno del carbonile e il legame tra l'azoto e il carbonio α di ciascun amminoacido, rispettivamente.
Inoltre, gli scienziati hanno stabilito che per ogni svolta dell'elica α viene presentata 3,6 rifiuti di aminoacidi e che questa svolta è sempre destrogiry nelle proteine. Oltre ad essere la struttura più semplice, l'elica α è la forma predominante nelle α-queratina e circa il 25% degli aminoacidi delle proteine globulari adotta questa struttura.
L'elica α è stabilizzata grazie al fatto che presenta numerosi ponti idrogeno. Pertanto, tre o quattro collegamenti di questo tipo sono stabiliti in ciascuna svolta dell'elica.
Nei ponti idrogeno, l'azoto di un legame peptidico e l'atomo di ossigeno del gruppo carbonilico del successivo aminoacido interagiscono, nella direzione del lato amino-terminale di quella catena.
Gli scienziati hanno dimostrato che un'elica α può essere formata con catene polipeptidiche formate da aminoacidi L o D, con la condizione che tutti gli aminoacidi abbiano la stessa configurazione stereoisomera. Inoltre, L-Eaminoacids naturali possono formare α droords con destra e sinistra.
Può servirti: immunoglobulina DTuttavia, non tutti i polipeptidi possono formare l'elica α stabile, poiché la loro struttura primaria influisce sulla stabilità di questo. Le catene R di alcuni aminoacidi possono destabilizzare la struttura, impedendo la formazione delle eliche α.
Β foglio
Nel foglio β o β piegato, ciascuno dei rifiuti di aminoacidi ha una rotazione di 180 ° in relazione al residuo di aminoacidi precedenti. In questo modo, si ottiene di conseguenza che lo scheletro della catena polipétide è esteso e in una forma a zigzag o fisarmonica.
Le catene polipeptidiche a forma di accordo in polvere possono essere posizionate adiacenti tra loro e producono ponti idrogeno lineari tra entrambe le catene.
Due catene polipeptidiche adiacenti possono essere disposte in parallelo, ovvero entrambe possono essere orientate nella direzione amino -carbossilica, formando il foglio β parallelo; o Possono trovarsi in direzioni opposte, quindi formando il foglio di antiparalla β.
Le catene laterali dei rifiuti di aminoacidi adiacenti si distinguono dallo scheletro della catena in direzioni opposte, dando origine a uno schema alternato. Alcune strutture proteiche limitano i tipi di aminoacidi delle strutture β.
Ad esempio, in proteine densamente confezionate, aminoacidi a catena corta, come glicina e alanina sulle loro superfici di contatto sono più frequenti.
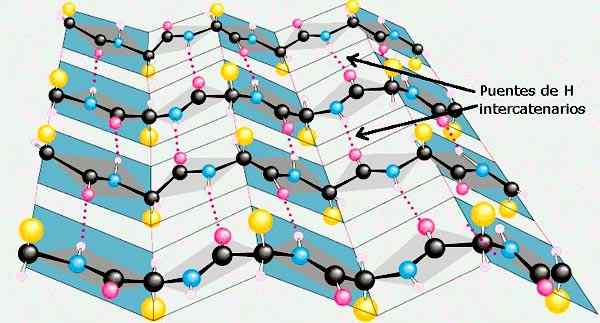 Il foglio β delle strutture secondarie delle proteine. Preso e curato da: Preston Manor School + JFL [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)].
Il foglio β delle strutture secondarie delle proteine. Preso e curato da: Preston Manor School + JFL [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Altre conformazioni della struttura secondaria
Helix 310
Questa struttura è caratterizzata dalla presentazione di 3 rifiuti di aminoacidi per round. Questa struttura è stata osservata in alcune proteine, ma non è molto frequente di natura.
Helix π
Questa struttura, nel frattempo, ha 4,4 rifiuti di aminoacidi dalla svolta a spirale e un ciclo di collegamento a 16 elementi idrogeno. Sebbene questa configurazione sia stericamente possibile, non è mai stata osservata in natura.
Può servirti: agar di patate destrosio: fondazione, preparazione e utilizzoLa possibile causa di questo può essere il suo centro vuoto, troppo grande per consentire le prestazioni delle forze di van der Waals che aiuterebbero a stabilizzare la struttura, e tuttavia è troppo piccolo per consentire il passaggio delle molecole d'acqua.
Struttura supersCunundaria
Le strutture superseccunde sono combinazioni di strutture secondarie di fogli β β α e fogli piegati. Queste strutture possono verificarsi in molte proteine globulari. Esistono diverse possibili combinazioni, ognuna delle quali ha caratteristiche particolari.
Alcuni esempi di strutture supersecundari sono: il unità βαβ, in cui due fogli β paralleli sono collegati da un segmento dell'elica α; IL unità αα, caratterizzato da due αici successivi ma separati da un segmento non elicoidale, associato alla compatibilità delle sue catene laterali.
Diversi fogli β possono ritirarsi su se stessi dando una configurazione di barile β, mentre un foglio β antipaallala si ritrae sul fatto che costituisca una struttura supersecundaria chiamata Chiave greca.
Riferimenti
- C.K. Mathews, k.E. Van Hold & K.G. Ahern (2002). Biochemery. 3a edizione. Benjamin / Cummings Publishing Company, Inc.
- R.Murray, p. Mayes, d.C. Granner & v.W. Rodwell (1996). Biochemery di Harper. Appleton & Lange.
- J.M. Berg, j.L. Tymoczko & l. Stryer (2002). Biochemery. 5a edizione. W. H. Freeman e compagnia.
- J.Koolman & K.-H. Roehm (2005). Atlante di colore biochimica. 2a edizione. Thieme.
- A. Lechinger (1978). Biochimica. Omega Editions, s.A.
- T. McKee e J.R. McKee (2003). Biochimica: le basi molecolari della vita. 3Rd Edizione. The McGraw-Hiii Companies, Inc.
- « Shock elastici in una dimensione, casi speciali, esercizi
- Caratteristiche del valore attuale, formule ed esempi »

