Struttura quaternaria delle proteine delle caratteristiche

- 3301
- 927
- Enzo De Angelis
IL Struttura quaternaria di proteine Definisce le relazioni spaziali tra ciascuna delle sue subunità di polipeptidi collegati da forze non covalenti. Nelle proteine polimeriche, ciascuna delle catene polipeptidiche che lo inventano sono chiamate subunità o protomeri.
Le proteine possono essere formate da uno (monomerico), due (dimérica), diversi (oligomerici) o molti protomeri (polimerici). Questi protomeri possono avere una struttura molecolare simile o molto diversa. Nel primo caso si dice che siano proteine omotipiche e nel secondo caso, eterotipico.
 Esempio di una struttura quaternaria di una proteina antigene nucleare cellulare di proliferazione. Preso e curato da: Thomas Shafee [CC da 4.0 (https: // creativeCommons.Org/licenze/by/4.0)].
Esempio di una struttura quaternaria di una proteina antigene nucleare cellulare di proliferazione. Preso e curato da: Thomas Shafee [CC da 4.0 (https: // creativeCommons.Org/licenze/by/4.0)]. Nella notazione scientifica, i biochimisti usano lettere greche con abbonamenti per descrivere la composizione dei protomeri proteici. Ad esempio, una proteina omotipica tetramericana è designata come α4, Mentre una proteina tetramericana formata da due diversi dimeri è designata come α2β2.
[TOC]
Struttura proteica
Le proteine sono molecole complesse che acquisiscono diverse configurazioni tridimensionali. Queste configurazioni sono esclusive per ogni proteina e consentono loro di svolgere funzioni molto specifiche. I livelli di organizzazione strutturale delle proteine sono i seguenti.
Struttura primaria
Si riferisce alla sequenza in cui sono disposti i diversi aminoacidi nella catena del polipeptide. Questa sequenza è data dalla sequenza del DNA che codifica tale proteina.
Struttura secondaria
La maggior parte delle proteine non sono lunghe catene di aminoacidi completamente estesi, ma hanno regioni che vengono regolarmente piegate sotto forma di eliche o fogli. Questo pieghevole è quello che si chiama struttura secondaria.
Struttura terziaria
Le aree piegate della struttura secondaria possono, a loro volta, piegare e assemblare in strutture più compatte. Quest'ultima piega è quella che dà alla proteina la sua forma tridimensionale.
Struttura quaternaria
Nelle proteine che sono formate da più di una subunità, le strutture quaternarie sono le relazioni spaziali che esistono tra ciascuna subunità, che sono collegate da legami non covalenti.
Può servirti: come i funghi respirano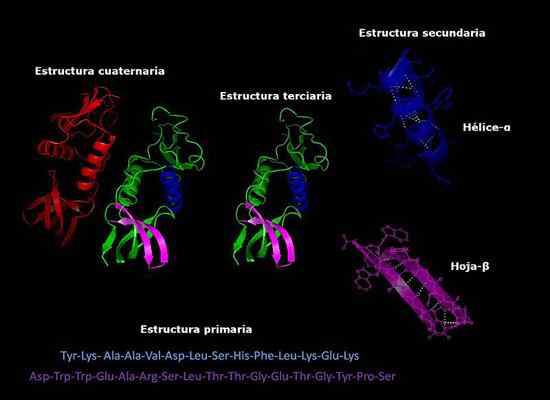 Strutture primarie, secondarie, terziarie e quaternarie delle proteine, conformazione tridimensionale. Preso e curato da: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)].
Strutture primarie, secondarie, terziarie e quaternarie delle proteine, conformazione tridimensionale. Preso e curato da: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Stabilità della struttura quaternaria
La struttura tridimensionale delle proteine è stabilizzata da interazioni deboli o non covalenti. Mentre questi collegamenti o interazioni sono molto più deboli dei normali legami covalenti, questi sono numerosi e il loro effetto cumulativo è potente. Successivamente vedremo alcune delle interazioni più comuni.
Interazioni idrofobiche
Alcuni aminoacidi contengono catene laterali idrofobiche. Quando le proteine possiedono questi aminoacidi, la piegatura della molecola ordina queste catene laterali nella proteina e le protegge dall'acqua. La natura delle diverse catene laterali fa sì che contribuiscano in modi diversi nell'effetto idrofobico.
Interazioni di van der waals
Queste interazioni si verificano quando molecole o atomi che non sono uniti da legami covalenti si avvicinano troppo tra loro, e per questo i loro orbitali elettronici più esterni iniziano a sovrapporsi.
A quel tempo viene stabilita una forza di repulsione tra questi atomi che cresce molto rapidamente con l'approssimazione dei loro rispettivi centri. Queste sono le "forze" di Van der Waals così chiamate.
Interazioni di carico
È l'interazione elettrostatica che si verifica tra un paio di particelle caricate. Nelle proteine si verificano questo tipo di interazioni, sia a causa della carica elettrica netta della proteina, sia del carico individuale degli ioni contenuti all'interno. Questo tipo di interazioni è talvolta chiamato Puente Salino.
Legami di idrogeno
Viene stabilito un legame idrogeno tra un atomo di idrogeno attaccato, mediante.
Questo tipo di legame è molto importante, poiché le proprietà di molte molecole, tra cui quella dell'acqua e delle molecole biologiche, sono in gran parte dovute a legami idrogeno. Le proprietà azionarie dei legami covalenti (gli elettroni sono condivisi) e anche delle interazioni non covalenti (interazione carico).
Può servirti: colture transitorieInterazioni di dipolos
Nelle molecole, comprese le proteine, che non presentano carico netto, è possibile presentare una disposizione non uniforme dei loro carichi interni, con un estremità leggermente più negativo di un altro. Questo è ciò che è noto come un dipolo.
Questa condizione di dipolo della molecola può essere permanente, ma può anche essere indotta. Dipolos può essere attratto da ioni o altri dipoli. Se i dipoli sono permanenti, l'interazione ha una portata maggiore di quella presentata con dipoli indotti.
Oltre a queste interazioni non covalenti, alcune proteine oligomeriche stabilizzano la loro struttura quaternaria mediante un tipo di collegamento covalente, il collegamento disolfuro. Questi sono stabiliti tra i gruppi di sulfidrillo dei cisteoni di diversi protomeri.
I legami disulfuro aiutano anche a stabilizzare la struttura secondaria delle proteine, ma in questo caso i rifiuti di cisteina si collegano all'interno dello stesso polipeptide (collegamenti disolfuro intrapopolipeptide).
Interazioni tra protomeri
Come notato in precedenza, nelle proteine composte da diverse subunità o protomeri, queste subunità possono essere simili (omotipiche) o diverse (eterotipiche).
Interazioni omotipiche
Le subunità che compongono una proteina sono catene polipeptidiche asimmetriche. Tuttavia, nelle interazioni omotipiche, queste subunità possono essere associate in diversi modi per raggiungere vari tipi di simmetria.
I gruppi che interagiscono con ciascun protomero sono generalmente situati in diverse posizioni, quindi sono chiamati interazioni eterologhe. Interazioni eterologhe tra le diverse subunità, a volte si verificano in modo tale che ogni subunità sia storta rispetto al precedente, una struttura elicoidale e una struttura elicoidale possono essere raggiunte.
In altre occasioni le interazioni sono riportate in modo tale che i gruppi di subunità definiti siano disposti attorno a uno o più assi di simmetria, in quella che è nota come simmetria di gruppo Point - Gruppo. Quando ci sono diversi assi di simmetria, ogni subunità si è rotta rispetto al suo vicino a 360 °/n (dove n rappresenta il numero di assi).
Può servirti: flora australiana e fauna: specie rappresentativeTra i tipi di simmetria ottenuti in questo modo ci sono, ad esempio, elicoidali, cubici e icosaedrici.
Quando due subunità interagiscono attraverso un asse binario, ogni unità ha rotto 180 ° rispetto all'altro, attorno a quell'asse. Questa simmetria è nota come simmetria C2. In esso, i siti di interazione in ciascuna subunità sono identici; In questo caso non si parla di interazione eterologa, ma di un'interazione isologa.
Se, al contrario, l'associazione tra i due componenti del dimero è eterologo, verrà ottenuto un dimero asimmetrico.
Interazioni eterotipiche
Non sempre le subunità che interagiscono in una proteina sono della stessa natura. Ci sono proteine che sono formate da dodici o più subunità.
Le interazioni che mantengono la stabilità della proteina sono le stesse delle interazioni omotipiche, ma si ottengono generalmente molecole completamente asimmetriche.
L'emoglobina, ad esempio, è un tester che presenta due coppie di diverse subunità (α2β2).
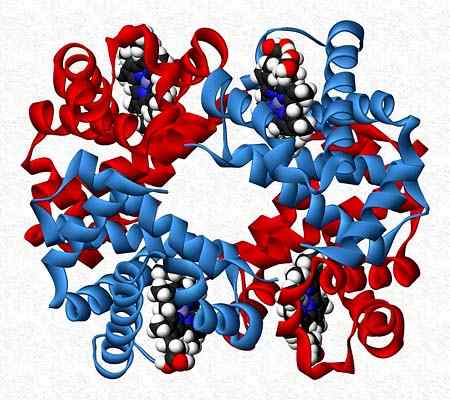 Struttura quaternaria dell'emoglobina. Preso e curato da: Benjah-BMM27. Modificato da Alejandro Porto. [CC0].
Struttura quaternaria dell'emoglobina. Preso e curato da: Benjah-BMM27. Modificato da Alejandro Porto. [CC0]. Riferimenti
- C.K. Mathews, k.E. Van Hold & K.G. Ahern (2002). Biochemery. 3a edizione. Benjamin / Cummings Publishing Company, Inc.
- R.K. Murray, p. Mayes, d.C. Granner & v.W. Rodwell (1996). Biochemery di Harper. Appleton & Lange
- J.M. Berg, j.L. Tymoczko & l. Stryer (2002). Biochemery. 5a edizione. W. H. Freeman e compagnia.
- J. Koolman & K.-H. Roehm (2005). Atlante di colore biochimica. 2a edizione. Thieme.
- A. Lechinger (1978). Biochimica. Omega Editions, s.A.
- L. Stryer (1995). Biochemery. W.H. Freeman and Company, New York.
- « XIX secolo nella popolazione, società, economia e politica del Cile
- Caratteristiche, struttura, funzioni e usi della vimentina »

