Pauling Scale

- 1966
- 162
- Enzo De Angelis
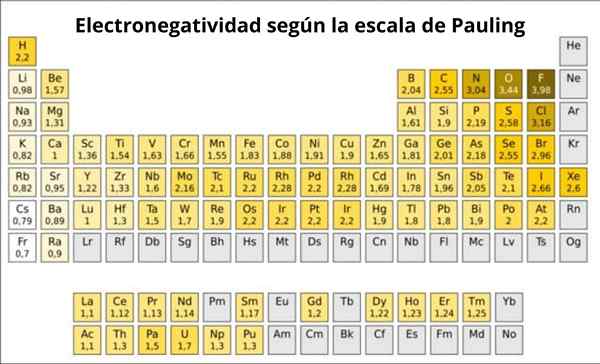 Figura 1. Pauling Scale. Fonte: Wikimedia Commons.
Figura 1. Pauling Scale. Fonte: Wikimedia Commons. Qual è la scala Pauling?
IL Pauling Scale È una scala arbitraria utilizzata in chimica per esprimere il Elettronegatività degli elementi. Questo è definito come la tendenza di un determinato atomo ad attrarre elettroni se combinato con un altro atomo.
In questo senso, gli elementi ad alta elettronegatività tendono a guadagnare facilmente gli elettroni. Questi sono non metalli, mentre per la loro parte, gli elementi meno elettronegativi come i metalli, è più facile per loro produrre elettroni.
Pertanto, conoscere l'elettronegatività di un elemento ha un'idea del tipo di collegamento che è in grado di formare se combinato con un altro. Lo vedremo con un esempio numerico in seguito.
Con queste informazioni puoi prevedere molte delle proprietà che un composto avrà, qualcosa di molto utile nella chimica sperimentale e per la scienza dei materiali, in cui vengono continuamente creati nuovi composti.
Tuttavia, è conveniente chiarire che nonostante quanto sia importante, non esiste un modo unico per determinare l'elettronegatività; La scala Pauling è solo una delle varie forme proposte per trovarla, sebbene sia una delle più utilizzate.
In effetti, Pauling è una scala arbitraria in cui un valore numerico viene assegnato a ciascun elemento della tabella periodica, che riflette la sua elettronegatività. Lo vediamo nella Figura 1, dove hai l'elettronegatività di ciascun elemento, come è stato assegnato dal premio Nobel Linus Pauling (1901-1994) intorno al 1939.
L'elettronegatività degli elementi
Pauling, accanto a Don M. Yost, ha trovato l'elettronegatività valori empiricamente, attraverso dati sperimentali ottenuti misurando l'energia del collegamento.
Pauling assegnato al fluoro.0. Quindi, quando il fluoro forma si collega, mostra la tendenza più alta per attirare elettroni tra tutti gli elementi.
Può servirti: numero di coordinamento: cosa è, calcolo, esempiIl secondo è ossigeno, con 3.5 e terzo sono azoto con 3.0. Entrambi si trovano sopra e a destra del tavolo.
D'altra parte, all'estremità opposta, l'elemento meno elettronegativo è il cesio, il cui simbolo è CS, situato a sinistra del tavolo, che Pauling ha assegnato il numero 0.7.
Elettronegatività nella tabella periodica
In generale e come osservato nella Figura 1, l'elettronegatività - e l'energia di ionizzazione - aumenta da sinistra a destra nella tabella periodica. La tendenza generale indica anche una diminuzione quando si sposta dall'alto verso il basso.
Pertanto gli elementi più elettronegativi li avranno nell'angolo in alto a destra del tavolo: fluoro, ossigeno, cloro, azoto. Il meno elettronegativo -o il più elettropositivo se si preferisce essere a sinistra: litio, sodio, potassio e altri elementi del gruppo 1 -la colonna dell'estrema sinistra, corrispondente a metalli alcalini e alcalini-.
In ogni colonna, l'elettronegatività diminuisce aumentando il numero atomico dell'elemento, tranne nei metalli di transizione al centro, che non seguono questa tendenza.
Un punto importante da evidenziare è che l'elettronegatività è relativa, non è una proprietà invariabile di ciascun elemento e viene misurata solo rispetto a quella di altri elementi. Dipende molto dallo stato di ossidazione, quindi lo stesso elemento può presentare una diversa elettronegatività, a seconda del tipo di composto che si forma.
Collegare la differenza di energia
 figura 2. Il chimico americano Linus Pauling nel 1955. Fonte: Wikimedia Commons.
figura 2. Il chimico americano Linus Pauling nel 1955. Fonte: Wikimedia Commons. In chimica, un collegamento è il modo in cui gli atomi sono uniti, lo stesso o diverso, per formare molecole. Tra gli atomi ci sono forze che li tengono insieme stabili.
Esistono diversi tipi di link, ma due sono considerati qui:
- Covalente, in cui atomi di elettronegatività simili condividono un paio di elettroni.
- Ionico, frequente tra atomi con diverse elettronegatività in cui prevale l'attrazione elettrostatica.
Supponiamo che due elementi a e b possano formare molecole tra loro, indicate AA e BB. E sono anche in grado di unirsi per formare un composto AB, tutto attraverso un qualche tipo di collegamento.
Grazie alla partecipazione delle forze intermolecolari, c'è energia nel collegamento. Ad esempio, l'energia nel collegamento AA è EAa, Nel collegamento BB è EBB e infine nel composto AB è EAb.
Se la molecola AB sarà formata da un legame covalente, teoricamente l'energia del collegamento è la media delle energie eAa e eBB:
EAb = ½ (EAa + EBB)
Pauling calcolato eAb Per diversi composti, lo ha misurato sperimentalmente e ha determinato la differenza tra i due valori, che chiamava Δ:
Δ = | (EAb) misurato - (EAb) Teorico | = | (EAb) misurato - ½ (eAa + EBB) |
Pauling ha ragionato in questo modo: se Δ è molto vicino a 0, significa che le elettronegatività di entrambi gli elementi sono simili e il collegamento che li unisce è covalente. Ma se Δ non è piccolo, allora il collegamento tra A e B non è puro covalente.
Maggiore è il valore assoluto di Δ, maggiore è la differenza tra l'elettronegatività degli elementi A e B e quindi il collegamento che UNE sarà di tipo ionico. Successivamente il lettore troverà un esempio in cui, calcolando Δ, è possibile determinare il tipo di collegamento di un composto.
Equazioni per l'elettronegatività
A partire dal fatto che la differenza di energia è il segnale che distingue la natura del legame, Pauling ha fatto molti esperimenti che lo hanno portato a creare un'espressione empirica per l'elettronegatività relativa di due elementi a E B che formano una molecola.
Indicando l'elettronegatività come χ (lettera greca "Chi"), Pauling ha definito Δ come segue:
F2· Δ = [χ (A) - χ (B)]2
χ (A) - χ (B) = F√δ = 0.102√δ
Può servirti: equilibrio tanteo: passaggi, esempi ed eserciziSi noti che Δ è una quantità positiva. Fatia f = 0.102 che appare moltiplicando la radice quadrata di Δ è il fattore di conversione tra KJ (kilojoules) ed EV (elettrone-volt), entrambe le unità di energia.
Se vengono utilizzati invece chilocalororie e volt elettronico, la differenza di elettronegatività è espressa con una formula simile ma con f = 0.208:
χ (A) - χ (B) = 0.208 pareti
Pauling ha iniziato ad assegnare all'idrogeno il valore di 2.1, un valore precedente ottenuto dal chimico Robert Mulliken. Ha scelto questo elemento come punto di partenza perché forma collegamenti covalenti con molti altri.
Attraverso l'equazione precedente, ha continuato ad assegnare valori relativi al resto degli elementi. Si è reso conto che l'elettronegatività aumenta quando si sposta da sinistra a destra e dall'alto verso il basso nella tabella periodica, come descritto nella sezione precedente.
Esempio
Di seguito è riportato un elenco di elementi: n, j e m e le rispettive elettronegatività χ secondo la scala Pauling:
-N: Χ = 4.0
-J: Χ = 1.5
-E: Χ = 0.9
-M: Χ = 1.6
Tra i seguenti composti formati con loro:
YJ, YN, MN e JM
Indica quello con il più grande carattere ionico e che la cui natura è covalente. Motivo la tua risposta.
Soluzione
Secondo i criteri stabiliti da Pauling, il composto con il più alto carattere ionico sarà quello con la più grande differenza tra elettronegatività e quindi un valore maggiore di Δ. Da parte sua, il composto con la differenza di energia più bassa è quello che ha un legame covalente.
Quindi calcoleremo quanto Δ vale per ogni composto, come segue:
Composto yj
Δ = [χ (y) - χ (j)]2 = (0.9 - 1.5)2 = 0.36
Composto yn
Δ = [χ (y) - χ (n)]2 = (0.9 - 4.0)2 = 9.61
Composto Mn
Δ = [χ (M) - χ (N)]2 = (1.6 - 4.0)2 = 5.76
Composto jm
Δ = [χ (J) - χ (M)]2 = (1.5 - 1.6)2 = 0.01
Dai risultati di cui sopra segue che il composto del carattere ionico è l'YN, il cui Δ = 9.61, mentre il composto del carattere covalente è il jm, con Δ = 0.01.

