Equilibrio chimico Spiegazione, fattori, tipi, esempi

- 2496
- 794
- Brigitta Ferrari
Lui Equilibrio chimico È uno stato che raggiunge le reazioni chimiche reversibili in cui non vengono prodotte alcuna variazione di concentrazioni o reagenti, né dei prodotti coinvolti. È caratterizzato dall'essere dinamico e non statico; Cioè, le molecole o gli atomi continuano a reagire, ma mantenendo le stesse concentrazioni durante il tempo.
Un equilibrio simile è presentato anche nelle variazioni di fase, sebbene non vi siano interruzioni di collegamento. Ad esempio, un liquido può essere in equilibrio con i suoi vapori, nonché come solido. Allo stesso modo, un solido stabilisce un equilibrio con le acque che lo circondano quando è precipitato o cristallizzato.
 Nel settore chimico, la conoscenza dell'equilibrio chimico è essenziale per ottenere la sintesi con rese migliori. Fonte: pxhere.
Nel settore chimico, la conoscenza dell'equilibrio chimico è essenziale per ottenere la sintesi con rese migliori. Fonte: pxhere. Una volta stabilito l'equilibrio chimico, non è possibile ottenere più cambiamenti o risposte a meno che non venga interrotto o influenzato da azioni esterne. È quindi, nella sintesi di un prodotto, vengono modificati diversi parametri come pressione, volume o temperatura.
Altrimenti, in equilibrio, le quantità di prodotti saranno insoddisfacenti; cioè, ci saranno scarse prestazioni di reazione. Ecco perché l'equilibrio chimico è vitale per l'industria chimica e in generale per qualsiasi sintesi indipendentemente dalla sua scala.
In equilibrio chimico potrebbero esserci più prodotti o più reagenti. Tutto dipende da dove viene sfollato l'equilibrio. Tenendo conto di diversi fattori, è possibile spostare un equilibrio verso una delle due direzioni della doppia freccia nella reazione reversibile.
[TOC]
Spiegazione dell'equilibrio chimico
Prima dell'equilibrio
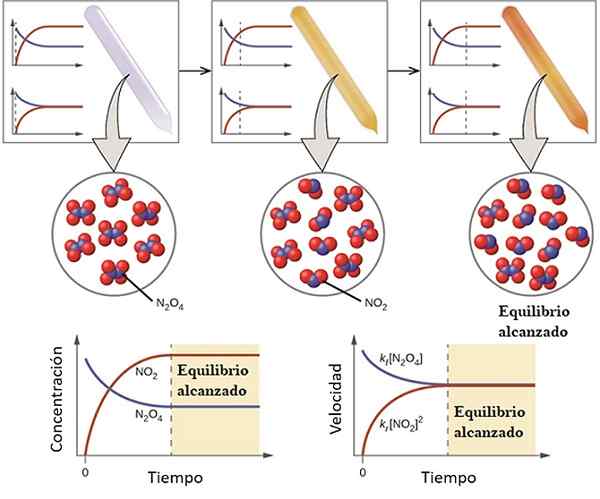 Esempio di come una reazione si sta avvicinando al suo equilibrio. Fonte: OpenStax/CC di (https: // creativeCommons.Org/licenze/by/4.0)
Esempio di come una reazione si sta avvicinando al suo equilibrio. Fonte: OpenStax/CC di (https: // creativeCommons.Org/licenze/by/4.0) Per capire quale sia l'equilibrio chimico considerare la seguente reazione reversibile:
N2O4(g) ⇌ no2(G)
Il gas n2O4 È incolore, mentre il gas no2 presenta una colorazione marrone o marrone. Se una quantità specifica di N viene iniettata in una piccola fiala o contenitore2O4, Questo sarà incolore fino a quando non sarà stabilito l'equilibrio.
A sinistra dell'immagine superiore, si può vedere che quasi tutte le molecole sono di n2O4 e che la concentrazione di no2 È zero.
Mostra anche due grafici che rappresentano come è la tendenza in bilancia2O4. Un grafico corrisponde alla concentrazione vs. Tempo (mano in basso) e l'altro corrisponde al grafico a velocità vs. Tempo (giù per la mano destra).
La concentrazione di n2O4, [N2O4] (linea blu) diminuirà gradualmente, poiché una parte di essa si dissocierà per produrre molecole di NO2. Quindi, essendo la concentrazione di NO2, [NO2] (linea rossa) uguale a zero all'inizio, aumenterà presto come N2O4 Dissociarsi.
Tuttavia, è una reazione reversibile: parte delle molecole2 Si uniranno a formare n2O4. Ci saranno, quindi, due reazioni, la diretta e l'inversa, ognuna con le proprie velocità.
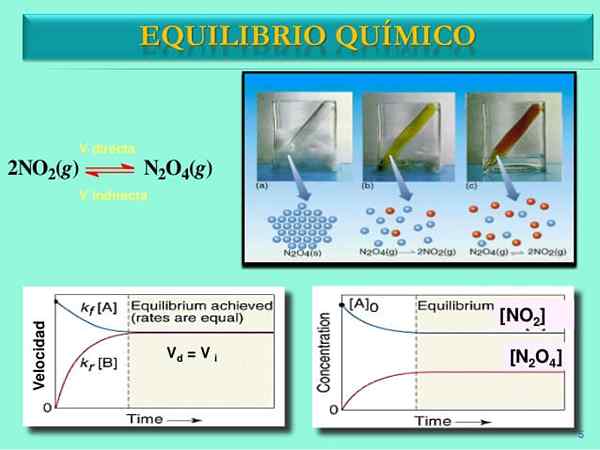 Fonte: slideshare.netto
Fonte: slideshare.netto Velocità di reazione
Inizialmente, la velocità di consumo di n2O4 è maggiore della velocità di consumo di no2. Ovviamente, avendo solo n2O4, le poche molecole formate da no2 Possono appena ritrovarsi a reagire. A questo punto, la fiala inizierà a formicolare l'arancia, perché c'è una miscela di n2O4 e non2.
A poco a poco, poiché ci sono più molecole di no2 Nella strada e che le molecole N2O4 Si dissociano, le velocità delle due reazioni corrispondono, anche se le concentrazioni differiscono l'una dall'altra. Cioè no2] tende ad essere maggiore di [n2O4], motivo per cui la linea rossa è sopra la linea bluastra.
Può servirti: proprietà fisico -chimicheSi noti che la velocità diventa cc/dt, cioè il cambiamento di concentrazione rispetto al tempo. Ecco perché i due C vs. t e V vs. non sono identici.
A conti fatti
Una volta la coppia n2O4-NO2 Impostare l'equilibrio, le velocità di entrambe le reazioni saranno abbinate e verranno ottenute le seguenti espressioni matematiche:
Vdiretto = k1[N2O4"
Vinversione = k-1[NO2"2
Vdiretto = Vinversione
K1[N2O4] = k-1[NO2"2
K1/K-1 = [No2"2/ [N2O4"
KEq = [No2"2/ [N2O4"
A questo punto, la strada verrà tinta anche più che marrone, poiché l'equilibrio è più sfollato per la formazione di [NO2". Cioè kEq, La costante di equilibrio deve essere maggiore di 1 tenendo conto della relazione più alta, [no2"2/ [N2O4".
Nelle concentrazioni di equilibrio [n2O4] e non2] Rimangono costanti, con entrambe le reazioni che si verificano alla stessa velocità: una certa quantità di N è semplicemente dissociata2O4, Lo stesso importo verrà prodotto immediatamente a causa della reazione di una certa quantità di NO2.
Per questo motivo, si dice che l'equilibrio chimico sia dinamico: le molecole n2O4 e non2 Stanno ancora partecipando alle reazioni anche quando non vi è alcun cambiamento nelle loro concentrazioni.
Ed essendo le uguali velocità di reazione per entrambi i sensi, la linea rossa e bluastra nella grafica V vs. T suona su una linea orizzontale.
Equilibrio costante
La costante di equilibrio per la reazione precedente sarà sempre la stessa, a una certa temperatura, indipendentemente da quanto n2O4 viene iniettato all'inizio nella strada. Questo sarà così anche se una miscela di n viene iniettata direttamente2O4 e non2, poi lasciato a riposo fino a raggiungere l'equilibrio.
Quando viene raggiunto l'equilibrio e le concentrazioni vengono misurate [n2O4] e non2], la relazione [no2"2/ [N2O4] darà lo stesso a kEq Per questa reazione. Più è più grande (Keq >> 1), più prodotti saranno in equilibrio. E il più piccolo (Keq << 1), más reactivos habrá en el equilibrio.
Concentrazioni [n2O4] e non2] non lo faranno sempre. Ad esempio, se piccoli volumi vengono iniettati nella fiala o se al contrario vengono iniettati torrenti di questi gas in un reattore, le quantità variano considerevolmente. Tuttavia, kEq Rimarrà uguale fino a quando la temperatura è la stessa in entrambi i processi.
KEq È suscettibile alle variazioni di temperatura: a una temperatura più elevata, sarà un valore maggiore. Cioè a una temperatura più elevata, in equilibrio tende alla formazione di più prodotti. Questo è così a meno che la reazione non sia esotermica, come verrà spiegato nella sezione seguente.
Fattori che influenzano l'equilibrio chimico
I fattori che influenzano l'equilibrio chimico in una reazione reversibile sono: concentrazione, pressione e temperatura.
- Concentrazione
In una reazione reversibile, secondo il principio di Le Chatlier, aumentando la concentrazione di un reagente, ci sarà uno spostamento dell'equilibrio chimico a destra, al fine di aumentare la concentrazione dei prodotti di reazione.
Al contrario, se un prodotto viene aggiunto alla reazione, l'equilibrio chimico si sposterà a sinistra, al fine di aumentare la concentrazione dei reagenti. Se la seguente reazione viene presa come esempio:
C (s) +o2(g) ⇌ 2 co (g)
Aumentando la concentrazione dei reagenti (C e O2), L'equilibrio si sposterà a destra, cioè verso la formazione del prodotto di monossido di carbonio (CO) (CO). Ma un aumento della concentrazione di CA produrrà uno spostamento dell'equilibrio a sinistra, per aumentare la concentrazione di C e O2.
Può servirti: gruppo carbonile: caratteristiche, proprietà, nomenclatura, reattività- Pressione
In una reazione sviluppata nella fase gassosa, una variazione del volume o nella pressione esercitata sui gas coinvolti in esso, produrrà un'alterazione nell'equilibrio, dipendente dal numero di moli dei reagenti e dei prodotti.
Se i componenti di una reazione (reagenti e prodotti) hanno differenze nel numero di moli coinvolti in una reazione, ad esempio la dimerizzazione del biossido di azoto (no2)
2 n2(g) ⇌2O4(G)
Un aumento della pressione esercitata sulla reazione in una fase gassosa, una conseguenza di una diminuzione o meno del volume della reazione, causerà uno spostamento dell'equilibrio chimico sul lato che ha meno moli di gas. In questo esempio: prodotto n2O4.
Al contrario, una diminuzione della pressione produrrà uno spostamento dell'equilibrio sul lato della reazione che possiede il maggior numero di moli di gas. Nell'esempio dato, si sposterà verso i reagenti (no2), Al fine di contrastare la diminuzione della pressione.
Se in una reazione di fase di soda le moli dei reagenti sono uguali alle moli dei prodotti, le variazioni della pressione non influenzeranno l'equilibrio chimico.
- Temperatura
Reazione endotermica
In una reazione endotermica, il calore può essere considerato come un reagente, poiché la sua fornitura è necessaria per la reazione:
A +Q ⇌ B
Q = calore fornito
Pertanto, in una reazione endotermica quando la temperatura aumenta, l'equilibrio si sposterà a destra. Nel frattempo, quando la temperatura diminuisce, l'equilibrio si muove a sinistra.
Il calore è parte dei reagenti, per consumarlo per trasformarsi in b.
Reazione esotermica
In una reazione esotermica, viene generato il calore, questo essendo un prodotto della reazione:
A ⇌ B +Q
In una reazione esotermica quando la temperatura aumenta, l'equilibrio si sposterà a sinistra (reagenti), poiché la produzione di calore aumenta. Nel frattempo, quando la temperatura diminuisce, l'equilibrio si sposterà a destra (prodotti).
Il calore è parte dei prodotti, quando la temperatura aumenta non sarà necessario contribuire con più calore all'ambiente. E pertanto, l'equilibrio cercherà di sfruttare il calore extra per produrre più reagenti; In questo caso, più di.
Tipi di equilibrio chimico
A seconda dello stato fisico dei componenti di reazione, l'equilibrio chimico può essere omogeneo o eterogeneo.
Equilibrio omogeneo
In questo tipo di equilibrio, Tutto Reagenti e prodotti hanno lo stesso stato di fase o liquido. Per esempio:
N2(g) +3 H2(g) ⇌ 2 NH3(G)
Ecco così2, Come H2 e il NH3 Sono sostanze gassose.
Equilibrio eterogeneo
Esiste quando non tutto Reagenti e prodotti hanno la stessa fase o condizione fisica. Per esempio:
2 Nahco3(s) ⇌ na2Co3(s) +co2(g) +H2O (g)
Qui abbiamo il Nahco3 e na2Co3 come solidi e il CO2 e h2O come gas o vapori.
Esempi di equilibrio chimico
Dissociazione dell'acido acetico in acqua
Acido acetico, Cho3COOH, Dissociate in acqua che stabilisce un equilibrio:
Cap3COOH (AC) + H2O (l) ⇌ Cho3COO-(AC) + H3O+(AC)
Reazione la cui costante di equilibrio è chiamata costante di acidità.
IsomerizzazioneOn del butano
Il gas N-Butano può essere isomerizzato in base alla seguente reazione reversibile per produrre l'isomero isomero:
Cap3Cap2Cap2Cap3(g) ⇌ Cho3Ch (Ch3)2(G)
Formazione di ossido nitrico nell'atmosfera
Nell'atmosfera, l'ossido nitrico può essere formato, sebbene molto a malapena, da azoto e ossigeno d'aria:
N2(g) + o2(g) ⇌ 2no (g)
Può servirti: qual è l'ambiente? (Esempi di calcolo)Il kEq Da questa reazione è 2 · 10-31 A 25 ºC, quindi verrà formata una quantità spregevole di no.
ReazioneON di comproduzione d'argento con AmonYoAC
Ioni d'argento, AG+, Possono essere completati con l'ammoniaca secondo la seguente reazione reversibile:
Ag+(Sole) + 2nh3(L) ⇌ [Ag (NH3)2"+(sole)
Esercizi risolti
Esercizio 1
Che tipo di equilibrio chimico corrisponde alla seguente reazione?
2NOCL (G) ⇌ 2NO (G) + CL2(G)
Questa reazione corrisponde a un equilibrio omogeneo, poiché tutte le sostanze coinvolte, NOCL, NO e Cl2, Sono gas.
Esercizio 2
Per la stessa reazione dall'alto, quale cambiamento di equilibrio potrebbe prevedere se la pressione aumentasse improvvisamente?
Contiamo le moli dei reagenti:
2nocl
Abbiamo 2 moli di nocl. Ora diciamo alle moli dei prodotti:
2No + Cl2
Abbiamo tre moli: due di no e uno di CL2. Ci sono più talpe gassose sul lato dei prodotti. Pertanto, un aumento della pressione farà passare l'equilibrio sul lato sinistro, verso la formazione di NOCL. In questo modo, il sistema cerca di ammorbidire gli effetti della pressione che favoriscono la formazione di NOCL e non di NO e Cl2.
Esercizio 3
Per la stessa reazione dall'alto, supponiamo che un volume considerevole di CL venga improvvisamente iniettato2. Cosa succederà a bilanciare?
Quando si aggiunge Cl2 al reattore o al contenitore, la sua concentrazione sta aumentando come prodotto della reazione. E quindi, l'equilibrio tornerà a sinistra, per formare più NOCL.
Esercizio 4
Se la dissociazione di NOCL a 227 ºC ha una costante di equilibrio a 4 di 4.5 · 10-4, Quale direzione è il bilanciamento sfollato?
Ancora una volta, essendo kEq Meno di 1 (4.5 · 10-4 < 1), en el equilibrio se espera que haya más NOCl que NO o Cl2, poiché è spostato a sinistra.
Esercizio 5
Secondo la seguente reazione in equilibrio:
[CO (Oh2)6"2+(AC) +4Cl-(AC) +Q ⇌ [COCL4"2-(AC) +6H2O (l)
E sapendo che il complesso [CO (oh2)6"2+ È rosa e che il complesso è [COCL4"2- È bluastro, quali cambiamenti ti aspetteresti di vedere se riscaldi un contenitore con [CO (oh2)6"2+? Cosa ti aspetteresti di vedere se dopo aver riscaldato il contenitore lo metterei in un bagno con ghiaccio?
La reazione è endotermica, in quanto assorbe il calore come un reagente. Pertanto, quando si riscuote il contenitore con [CO (OH2)6"2+, L'equilibrio si sposterà a destra, verso la formazione di [COCL4"2-. Sarà un cambiamento di colorazione rosa bluastra.
Quindi, se il contenitore di colorazione bluastro con [COCL4"2- È posto in un bagno con ghiaccio, la reazione ora si sposterà a sinistra, verso la formazione di CO (Oh2)6"2+:
[Cocl4"2-(AC) +6H2O (l) ⇌ [co (oh2)6"2+(AC) +4Cl-(AC) +Q
Questo perché la reazione inversa è esotermica, con il calore che come prodotto. Pertanto, quando si raffredda il contenitore con [COCL4"2- Blu, il complesso [co (oh (oh2)6"2+, E il colore rosa riapparirà.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Preparazione emedical. (S.F.). Tipi di equilibrio. Recuperato da: emedicprep.com
- Lume Chimica sconfinata. (S.F.). Fattori che si equilibrio chimico appiccicoso. Recuperato da: corsi.Lumenarning.com
- Wikipedia. (2020). Equilibrio chimico. Recuperato da: in.Wikipedia.org
- Chimica librettexts. (24 maggio 2020). Calcoli di equilibrio - ESSAZIONI ILLUSTRATIVE. Recuperato da: Chem.Librettexts.org
- Meyers Amy. (2020). Equilibrio: chimico e dinamico. Studio. Recuperato da: studio.com
- Helmestine, Anne Marie, PH.D. (11 febbraio 2020). Equilibrio chimico nelle reazioni chimiche. Recuperato da: Thoughtco.com
- « Caratteristiche, tradizioni e costumi delle culture del Guatemala
- Elettroforesi di fondazione, tecnica, a cosa serve, esempi »

