Elettroforesi di fondazione, tecnica, a cosa serve, esempi

- 3510
- 1123
- Dante Morelli
IL Elettroforesi È una tecnica usata per separare le molecole in un campo elettrico. Deve, in particolare, con la migrazione di particelle caricate sotto l'influenza di una corrente elettrica applicata tra due poli, uno positivo e un altro negativo.
L'elettroforesi è attualmente una delle procedure più di routine che si svolgono durante lo sviluppo di un esperimento, in particolare nei campi legati alla chimica analitica, alla biochimica e alle scienze biologiche e mediche in generale.
 Bucket di elettroforesi. Fonte: Melodygar/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0)
Bucket di elettroforesi. Fonte: Melodygar/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0) Viene utilizzato per separare proteine, peptidi, DNA, RNA e altri in base al loro carico, dimensioni, densità e purezza.
Le diverse case commerciali hanno progettato diversi formati, con applicazioni diverse e profitti appropriati per scopi specifici, tuttavia, tutte le procedure richiedono gli stessi elementi di base:
- Una fonte di energia per generare carica elettrica
- Un mezzo di supporto per la separazione
- Una soluzione tampone (respingente) Per mantenere costante il pH
[TOC]
Base
L'elettroforesi non è altro che la migrazione (separazione) di particelle o molecole caricate (naturalmente o artificialmente) in un mezzo o supporto sotto l'influenza di un campo elettrico.
La tecnica si basa su una delle principali equazioni fisiche dell'elettromagnetismo, in base alla quale la forza è uguale alla carica elettrica moltiplicata per il campo elettrico applicato in quel punto (F (forza) = Q (carica elettrica) x E (campo elettrico ).
Secondo questa equazione, due particelle con la stessa massa, ma di carico diverso, passano a velocità diverse nello stesso campo elettrico. Inoltre, la velocità di movimento di queste particelle dipenderà dalla relazione tra il loro carico e la loro massa.
Gli scienziati hanno sfruttato queste proprietà e le relazioni cargo/di massa per separare i componenti dalle biomolecole nelle loro parti più piccole, nonché per separare le diverse molecole in una miscela, tra le altre applicazioni.
È importante ricordare che molecole biologiche come aminoacidi, peptidi, proteine, alcuni carboidrati, nucleotidi e acidi nucleici hanno tutti qualcosa che chiamiamo "gruppi ionizzabili", quindi possono esistere come specie positive o caricate negativamente in determinate condizioni di pH.
Tecnica
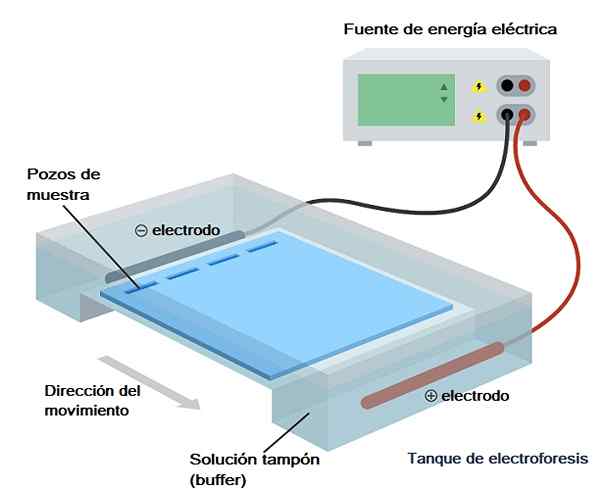
Sebbene esistano vari tipi di elettroforesi, l'elettroforesi su gel è la più utilizzata nell'analisi biochimica, nella biologia molecolare e nella biotecnologia, quindi sarà ciò di cui parleremo brevemente in termini tecnici.
Come suggerisce il nome, l'elettroforesi su gel implica l'uso di un mezzo di supporto solido a forma di solido, sia per l'analisi/separazione delle miscele di proteine o acidi nucleici (DNA e/o RNA) sotto l'influenza di un campo elettrico.
Il sistema o l'apparato utilizzato per eseguire una "corsa" elettroforetica può essere orizzontale (solitamente utilizzato per gli acidi nucleici) o verticali (solitamente utilizzati per la proteina).
- Esempio della tecnica dell'elettroforesi di acido nucleico
Gli acidi nucleici sono generalmente separati usando gel di agarosio (polisaccaride di galattosio) che viene preparato con una soluzione tampone adeguata (Tris/acetato/EDTA o Tris/borato/EDTA) e la cui concentrazione determinerà la "risoluzione" di frammenti di diverse dimensioni.
Può servirti: catena alimentare terrestre: collegamenti ed esempiopreparazione del campione
Il primo passo prima di eseguire una corsa elettroforetica in un gel di agarosio è ottenere il campione. Ciò dipenderà dall'estremità sperimentale e i campioni possono essere il prodotto di una digestione enzimatica, da una reazione a catena della polimerasi (PCR), una purificazione di acidi nucleici, ecc.
 Mescola del campione con il buff di carico.Org/licenze/by/4.0) via Wikimedia Commons)
Mescola del campione con il buff di carico.Org/licenze/by/4.0) via Wikimedia Commons) Dopo aver ottenuto, questo viene miscelato con una soluzione colorata (soluzione di carico) che consente la rapida deposizione del campione in un pozzo, poiché ha glicerolo e colorante che consente la corsa visivamente.
Preparazione del gel
Questo passaggio consiste nel miscelare la quantità necessaria del substrato di gelificazione (l'agarosio) con la soluzione tampone, sciogliendolo usando il calore e consolidandolo su un supporto che funziona come "muffa".
Durante la gelificazione alcuni "pettini" vengono introdotti nel gel posizionato nello "stampo" per delimitare i "pozzi" in cui i campioni verranno introdotti prima della corsa.
Una volta che il gel si è raffreddato e solidificato, i "pettini" vengono rimossi e viene introdotto in un contenitore noto come "secchio", che è pieno di soluzione tampone in esecuzione (Tris/acetato/EDTA o Tris/borato/borato/EDTA).
Questo secchio è, a sua volta, incluso in quella che viene chiamata "camera elettroforetica", che non è altro che il contenitore attraverso il quale viene superato il campo elettrico e che ha uno spazio in cui viene introdotto il gel e due sezioni con cui sono pieni soluzione tampone (respingente correre).
Questa fotocamera ha due elettrodi, uno positivo e uno negativo, tra cui il movimento ionico viene prodotto dopo l'applicazione di un campo elettrico (è collegato a una sorgente di alimentazione).
Caricamento di campioni
Una volta che i campioni si sono miscelati con la rispettiva soluzione di carico, questi vengono introdotti nei "pozzi" precedentemente realizzati nel gel.
Poiché gli acidi nucleici hanno un carico netto negativo, migrano dal polo negativo al positivo, quindi questo deve essere preso in considerazione quando la fotocamera è collegata alla fonte di alimentazione, garantendo che il polo negativo corrisponda al più sito accanto al luogo dove sono stati caricati i campioni.
Il tempo di Corrida è stabilito in rigorosa dipendenza dal ricercatore responsabile dell'esperimento. La tensione è generalmente calcolata in un rapporto percentuale a 5 volt nel gel che separa i due elettrodi.
Schermo
Quando il gel funziona (quando i campioni hanno percorso il gel da un'estremità all'altra), viene immerso in una soluzione di bromuro etide (ETBR), una tintura che è intervallata tra le basi azotate e che il "marchio", quindi Possono essere visualizzati in un transilumenante usando la luce ultravioletta.
A cosa serve l'elettroforesi?
L'elettroforesi è stata storicamente utilizzata con più scopi. Oggi, tuttavia, la sua utilità dipende in gran parte dalla "questione" che il ricercatore sia posta in relazione a un fenomeno o un particolare sistema, nonché dal tipo di elettroforesi che desidera usare.
Può servirti: topoisomerasi: cosa sono, caratteristiche, funzioni, tipiTuttavia, possiamo arruolare alcune delle funzioni principali che questa tecnica ha, a partire dal più "raro" e alla fine dal più popolare e per lo più sfruttato nel mondo delle scienze biologiche. L'elettroforesi è utile:
- Per l'analisi quantitativa di miscele complesse di macromolecole e per il calcolo del potenziale "zeta" (proprietà colloidale di una particella in un mezzo liquido sotto l'influenza di un campo elettrico statico).
- Per l'analisi dei sieri del sangue per scopi diagnostici.
- Per la separazione di glucoproteine, lipoproteine ed emoglobina nel sangue.
- Per l'analisi alimentare, prodotti farmaceutici e inquinanti ambientali.
Elettroforesi in gel di agarosio
- Per la separazione dei frammenti di DNA dopo la digestione con enzimi di restrizione.
- Per la separazione delle molecole di acido nucleico prima del trasferimento alle membrane per le analisi successive.
- Per l'analisi dei prodotti PCR (reazione a catena della polimerasi) che verifica se si è verificato o meno.
- Per la stima della dimensione delle molecole in una miscela di DNA o RNA.
- Per la stima della quantità e/o della qualità degli acidi nucleici purificati.
Elettroforesi in gel di poliacrilammide in condizioni denaturalizzanti o native
- Per determinare la dimensione di una proteina.
- Per identificare le proteine.
- Per determinare la purezza di un campione dopo diverse fasi di purificazione.
- Per identificare la presenza di collegamenti disolfuro intramolecolari.
- Per determinare l'interazione tra le proteine.
- Per determinare il punto isoelettrico di una proteina.
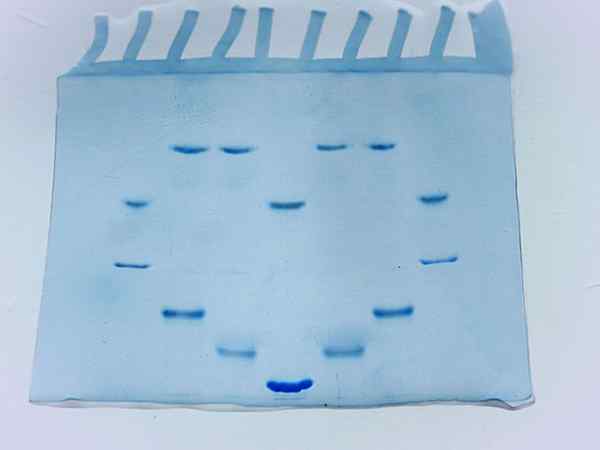 Fotografia di un gel di acrilamide dopo la corsa di diversi campioni di proteine (Fonte: Larionova.Marina/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0) via Wikimedia Commons)
Fotografia di un gel di acrilamide dopo la corsa di diversi campioni di proteine (Fonte: Larionova.Marina/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0) via Wikimedia Commons) Fattori che influenzano l'elettroforesi
La migrazione di una particella in un campo elettrico dipende da vari fattori, tra cui:
- La tua carica elettrica
- La sua dimensione molecolare
- La sua idrofobicità e la sua forma
- L'entità del campo elettrico che viene applicato
- La temperatura del sistema e la forza ionica della soluzione tampone utilizzata
- La natura dell'ambiente in cui si trova
In relazione al campione
Tra i parametri relativi alle particelle (campione) soggette a un campo elettrico, i principali fattori che influenzano questo processo hanno a che fare con il loro carico, le loro dimensioni e forma.
Maggiore è il carico netto di una particella, maggiore è il tasso di migrazione e questa grandezza dipenderà dal pH. Tuttavia, la relazione con le dimensioni è inversamente proporzionale, il che significa che più "grande" è la molecola, più lentamente migra.
Può servirti: lia agar (ferro lisina): cosa è, base, preparazione, usiIn relazione al campo elettrico
Finora abbiamo parlato dell'importanza del campo elettrico per ottenere il movimento di una particella per elettroforesi, ma non abbiamo definito ciò che è: forza elettrica per unità di carico o, in termini più semplici, una regione di spazio in cui c'è una forza elettrica.
I parametri relativi al campo elettrico che possono influire sulla migrazione sono la tensione, la corrente e la resistenza.
La tensione influisce sul "tempo di volo" delle molecole separate dopo l'applicazione del campo elettrico. Più è più alto, più velocemente si muovono.
La corrente (elettroni continui e uniformi che vengono "spinti" dalla sorgente di tensione) viene condotta tra gli elettrodi del sistema elettroforetico grazie agli ioni presenti nella soluzione tampone. È direttamente correlato alla tensione.
In relazione alla soluzione tampone
La composizione, la forza ionica e il pH della soluzione tampone sono i principali parametri che influenzano una "corsa" elettroforetica, poiché influenzano direttamente alcune delle proprietà dei campioni, in particolare la carica elettrica.
Perché? La soluzione tampone stabilizza il pH del mezzo di supporto in cui si verifica l'elettroforesi. La sua composizione può influenzare lo spostamento delle particelle di migrazione e anche la concentrazione ionica, poiché è direttamente correlata alla corrente.
In relazione al mezzo di supporto
I diversi tipi e formati di elettroforesi presentano anche diversi media su cui si verifica la migrazione e dove può essere successivamente "registrato".
Il tasso di migrazione delle molecole soggette all'elettroforesi dipende dal tipo di mezzo di supporto, che di solito dovrebbe essere inerte.
Le sue caratteristiche di assorbimento, l'elettrodo-osmosi sono importanti (capacità di movimento di un liquido attraverso una membrana sotto l'influenza di un campo elettrico) e la sua capacità molecolare del setaccio.
Esempi di utilizzo dell'elettroforesi
Esempi classici di tecniche elettroforetiche utilizzate in biologia e biotecnologia includono:
- Elettroforesi in gel di agarosio (inglese Gel di elettroforesi)
- Elettroforesi in gel di acrilamide in condizioni denaturalizzanti (SDS-PAGE, inglese Elettroforesi su gel poliacrilammide di dodecil solfato di sodio)
- Elettroforesi in gel di acrilamide in condizioni native (BN-PAGE, inglese Elettroforesi in gel di poliacrilammide nativa blu)
- Elettroforesi in due dimensioni (2D page, dall'inglese Elettroforesi su gel di poliacrilammide bidimensionale)
- Elettroforesi capillare (dall'inglese Elettroforesi capillare)
- Isolectoenfoque (inglese Isolectrofocando)
- Elettroforesi sul campo pulsato (inglese Elettroforesi sul campo pulsato)
Riferimenti
- Beck, Kevin. (2020, 25 maggio). I tipi di elettroforesi. Scientifico.com. Estratto dalla scienza.com
- Saggi, Regno Unito. (Novembre 2018). Tipi e applicazioni di elettroforesi. Estratto da Ukessays.com
- Nelson, d. L., Lechinger, a. L., & Cox, m. M. (2008). Principi di biochimica Lechinger. Macmillan.
- Parmar, p. (Agosto 2018). Elettroforesi: significato, definizione e classificazione (con diagramma). Bio Technology. Estratto dalla biotecnologia.com
- Perrett, d. (2010). 200 anni di elettroforesi. Cromatog. Oggi, 4-7.
- Righetti, p. G. (2005). Electroforesi: The March of Pennies, The March of Dimes. Journal of Chromatography A, 1079 (1-2), 24-40.
- Rilbe, h. (1995). Som Reminisciones of the History of Electroforesi. Elettroforesi, 16 (1), 1354-1359.
- Vesterberg, o. (1993). Una breve storia di metodi elettroforetici. Elettroforesi, 14 (1), 1243-1249.
- Vinayagam, m. (Nessuna data). Fattori che influenzano l'elettroforesi. Accademia.Edu. Estratto dal mondo accademico.Edu
- « Equilibrio chimico Spiegazione, fattori, tipi, esempi
- Origine della cultura Toltec, posizione, caratteristiche, organizzazione »

