Entalpía
- 1015
- 132
- Dante Morelli
Ciò che è entalpico?
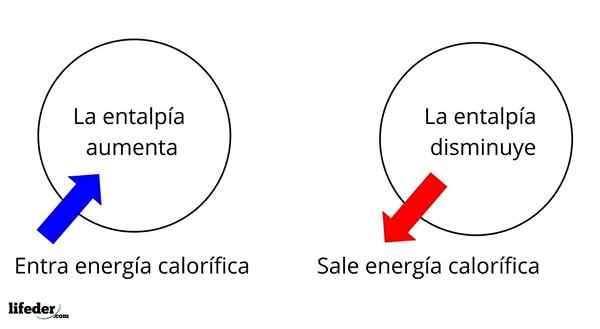
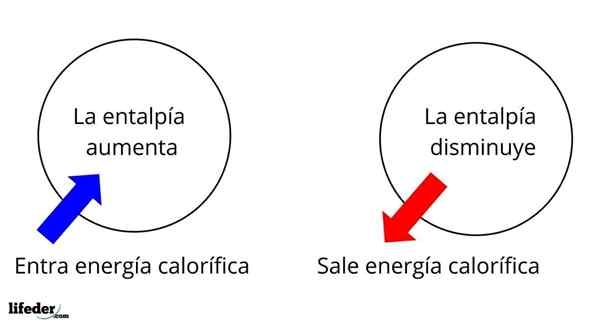
IL Entalpía È una proprietà termodinamica la cui variazione, a condizioni di temperatura costante e pressione, determina l'energia calorica di una sostanza o un sistema associata a una reazione chimica o un processo fisico. Essendo una funzione di stato, è rappresentata con la lettera nel capitale H, essendo ΔH la sua variazione.
È una delle proprietà più ampie più fondamentali per studiare la termochimica di molte reazioni; Cioè, parliamo del distacco o dell'assorbimento del calore tra il mezzo di reazione e l'ambiente circostante. Pertanto, diciamo che una reazione è esotermica se la sua ΔH è negativa (ΔH 0).
 Il cambiamento di entalpia nello scioglimento del ghiaccio è positivo, indicando che il ghiaccio assorbe il calore dall'ambiente per spostarsi allo stato liquido, l'acqua
Il cambiamento di entalpia nello scioglimento del ghiaccio è positivo, indicando che il ghiaccio assorbe il calore dall'ambiente per spostarsi allo stato liquido, l'acqua Il ghiaccio, per esempio, ha un entalpia, hghiaccio, Mentre l'acqua ha anche la sua entalpia, hacqua. Quando il ghiaccio si scioglie, si verifica una variazione di entalpia, chiamata ΔHFU o calore di scioglimento (hacqua-Hghiaccio). L'entalpia d'acqua è superiore al ghiaccio, causando ΔHFU Perché il ghiaccio è positivo e ha un valore di +6.01 kj/mol.
L'entalpia e la sua variazione sono generalmente espressi in unità di joule o calorie. Il cambiamento di entalpia +6.01 kj/mol indica che un mole di ghiaccio deve assorbire 6.01 kJ di energia calorica o calore per sciogliere.
Come viene calcolata Entalpia?
Entalpia e la sua variazione
L'entalpia stessa è incalcolabile, perché dipende da variabili difficili da misurare esattamente. Un buon confronto sarebbe quello di voler misurare il volume totale degli oceani: ce ne saranno sempre porzioni sotto la terra o sparse tra i continenti. Pertanto, e in pratica, non può essere determinato; Ma sì ΔH.
Può servirti: colloidePer raggiungere un'espressione matematica che consente il calcolo di ΔH, deve prima essere lasciato alla definizione fondamentale di entalpia:
H = u + pv
Essere l'energia interna del sistema o la sostanza in questione e PV il lavoro di volume di pressione che questo sistema esercita sull'ambiente circostante. Dato che siamo interessati a calcolare ΔH e no h, abbiamo:
ΔH = ΔU + Δ (PV)
Se la pressione è costante, l'equazione rimarrà:
ΔH = ΔU + PΔV
Sappiamo d'altra parte che:
ΔU = Q + W
Essendo Q calore e lavoro. Sostituirci:
ΔH = Q + W + PΔV
Ma inoltre, lo sappiamo:
W = - pΔv
E quindi:
ΔH = Q - PΔV + PΔV
ΔH = Q
Cioè, il ΔH per una reazione o un processo, effettuato a pressione costante, sarà uguale al calore Q generato o assorbito.
Reazioni Entalpy Cambia
Il presupposto che la pressione rimanga costante è possibile se la reazione si verifica sotto l'atmosfera terrestre. Ad esempio, il ghiaccio dei paesaggi invernali si scioglie senza provare un'altra pressione rispetto a quella della nostra atmosfera. D'altra parte, si applica anche per le reazioni nei media liquidi o per quelle che non producono grandi quantità di gas.
Queste reazioni assorbono o rilasciano calore Q uguale a ΔH, che a sua volta è la differenza nelle entalpie tra prodotti e reagenti:
ΔH = HProdotti - HReagenti
Tipi di entalpia
È una pratica comune parlare di ΔH e H come se fossero gli stessi: entrambi sono chiamati entalpie. Tuttavia, quando si tratta dei tipi, H è unico per ogni sostanza o sistema; Mentre ΔH, d'altra parte, è soggetto alla natura della reazione o del processo in se stessi.
In questo senso, abbiamo innanzitutto variazioni di entalpia positiva (ΔH> 0) o negative (ΔH <0); unas corresponden a los procesos o reacciones endotérmicos (se enfrían los alrededores), mientras las segundas tienen que ver con los procesos o reacciones exotérmicos (se calientan los alrededores).
Può servirti: nitrobenzene (C6H5N2): struttura, proprietà, usi, rischiIl segno '+' o '-' che accompagna ΔH ci dice quindi se c'è liberazione o assorbimento del calore in una certa reazione o processo; che hanno le loro caratteristiche ΔH, come parte delle loro proprietà termochimiche.
Abbiamo infiniti di tipi di entalpie, che possono essere classificati in base a processi fisici o reazioni chimiche.
Processi fisici
Entalpia di cambiamento di fase
Le sostanze devono assorbire o rilasciare calore per spostarsi da una fase di materiale o materiale (solido, liquido o gas) a un altro. Ad esempio, il ghiaccio assorbe il calore per sciogliersi, quindi l'entalpia per questo cambiamento di fase corrisponde alla fusione, ΔHFU, Chiamato anche calore di calore latente.
Entalpia di dissoluzione o miscela
Le sostanze se sciolte o miscelate in un mezzo di solvente possono assorbire o rilasciare calore, avendo così un'entalpia ΔHDis o ΔHMescolare.
Reazioni chimiche
Entalpia di formazione
È il calore associato, ΔHºF, alla formazione di un composto, in particolare una mole, dai suoi elementi costituenti in condizioni standard di pressione e temperatura (t = 298.15 K e p = 1 atm).
Entalpia di decomposizione
È il calore associato, ΔHdes, al degrado di un composto in sostanze più piccole e semplici. È generalmente positivo, perché è necessario il calore per rompere i legami delle molecole.
Entalpia di idrogenazione
È il calore associato, ΔHH, Alla dipendenza da una molecola di idrogeno a un composto, di solito un idrocarburo.
Entalpia di combustione
È il calore rilasciato, ΔHpettine, Quando una sostanza brucia reagendo con ossigeno. È negativo, perché il calore e la luce vengono rilasciati (fuoco).
Può servirti: massa atomica: definizione, tipi, come calcolarlo, esempiEsempi di entalpie
Infine, verranno fatte menzione di alcuni esempi specifici di entalpie:
Combustione di metano
Cap4 + 22 → CO2 + 2h2O
ΔH = -890.3 kJ/mol
Cioè un mole di Cho4 Quando la combustione libera 890.3 kJ di energia calorica.
Idrogenazione dell'etilene
Cap2= Ch2 + H2 → Ch3Cap3
ΔH = -136 kJ/mol
Una mole di etilene rilascia 136 kJ di calore quando l'idrogeno diventa un etano.
Sale in acqua
Table Sale, NaCl, si dissolve nell'acqua per separare gli ioni Na+ e cl- di reti cristalline e surround (idrato) delle molecole d'acqua:
NaCl (S) → Na+(AC) + CL-(AC)
ΔH = +3.87 kJ/mol
Cioè, dissolvendo il sale in acqua, di conseguenza per raffreddare il vetro o il contenitore. Tuttavia, la quantità di calore assorbita è molto piccola, quindi le nostre mani avranno solo un leggero cambiamento di temperatura.
Dissoluzione del clorato di potassio in acqua
D'altra parte, il clorato di potassio, KCLO3, Ha un ΔHDis Molto positivo:
Kcl3(s) → K+(AC) + CLO3-(AC)
ΔH = +41.38 kJ/mol
Il che significa che per dissolversi nell'acqua si assorbe molto caldo. E quindi, il contenitore si raffreddirà in modo significativo e vedremo che il vapore acqueo circostante inumidirà la sua superficie esterna.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Wikipedia. (2020). Entalpy. Recuperato da: in.Wikipedia.org
- Helmestine, Anne Marie, PH.D. (28 agosto 2020). Definizione entalpia in chimica e fisica. Recuperato da: Thoughtco.com
- Andrew Rader Studios. (2015). Energia ed entalpia. Recuperato da: Physics4kids.com
- Remoto. (2020). Fatti entalpici per i bambini. Estratto da: fatti.Remoto.co
- Amministratore. (21 dicembre 2010). L'entalpia. Recuperato da: chimico ossyorganico.com
- María Estela Raffino. (11 luglio 2020). Concetto di entalpia. Recuperato da: concetto.Di

