Energia ionizzata
- 2719
- 528
- Enzo De Angelis
Cos'è l'energia di ionizzazione?
IL energia ionizzata, Rappresentato dal simbolo I, è la quantità minima di energia necessaria per avviare l'elettrone esterno a una mole di atomi in uno stato gassoso, nel suo stato fondamentale. In altre parole, è la minima quantità di energia richiesta per trasformare un mole di atomi neutri in uno stato gassoso in un mole di ioni con un carico positivo (da qui il nome).
Visto sotto forma di un'equazione chimica, l'energia di ionizzazione sarebbe l'energia richiesta per il seguente processo:
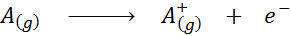
L'energia di ionizzazione è una misura diretta di quanto fortemente gli elettroni più esterni di un elemento chimico siano collegati. Quando si definisce l'energia del processo di ionizzazione gassosa dello stato, viene evitato il contributo o l'interferenza delle interazioni intermolecolari che si verificano negli stati liquidi e solidi.
In questo modo, si assicura che l'energia di ionizzazione dipenda solo dalle forze interne dell'atomo e, in particolare, dalla stabilità degli elettroni che formano lo strato di valenza di ciascun elemento.
Il processo di rimozione di un elettrone dallo strato di Valencia è un processo che richiede energia, quindi è un processo endotermico. Per questo motivo, le energie di ionizzazione sono sempre positive (per convenzione, quando l'energia entra in un sistema è considerata positiva).
C'è più di un'energia di ionizzazione
Sebbene la definizione di energia di ionizzazione sia applicata ad atomi neutri che diventano ioni positivi (cioè cationi), può anche essere applicata alla successiva rimozione di elettroni a ioni positivi, cioè specie che già hanno perso elettroni.
In questo senso, l'energia per ionizzare l'atomo neutro diventa solo la prima di molte possibili energie di ionizzazione, poiché ce n'è una per ogni elettrone che ruota attorno al nucleo.
Può servirti: quali sono gli elementi del movimento?In altre parole, le energie associate a tutti i seguenti processi sono considerate energie di ionizzazione:
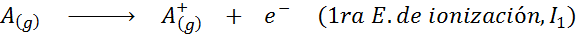
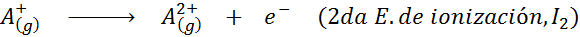
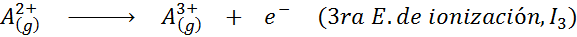
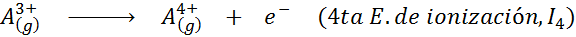
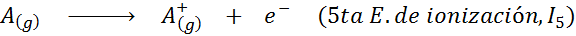
Ordine di energie di ionizzazione successiva
Per qualsiasi atomo di qualsiasi elemento, è soddisfatto che un'energia di ionizzazione sarà sempre maggiore di tutte le precedenti energie di ionizzazione. In altre parole, le successive energie di ionizzazione hanno la seguente relazione:
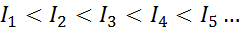
Il motivo per cui questo accade è molto semplice. La prima energia di ionizzazione prevede la rimozione di un elettrone in un atomo neutro. Tuttavia, la seconda energia di ionizzazione implica che portare un elettrone a un atomo che ha già perso il primo.
L'assenza di un elettrone lascia un carico netto positivo che attira con più resistenza gli elettroni rimanenti, quindi sono più difficili da iniziare. Inoltre, questa assenza riduce anche l'effetto dello scudo che gli elettroni hanno sugli elettroni più esterni, quindi il nucleo è in grado di attirarli più fortemente.
Il risultato è che è più difficile avviare il secondo elettrone rispetto al primo, e sarà più difficile iniziare il terzo rispetto al secondo, e così via, come si può vedere nella seguente tabella di energia di ionizzazione per i primi 10 elementi della tabella periodica.
Z | Elemento | Primo | Secondo | Terzo | Trimestre | Quinto | Sesto |
1 | H | 1312 | |||||
2 | Lui | 2373 | 5251 | ||||
3 | Li | 520 | 7300 | 11815 | |||
4 | Essere | 899 | 1757 | 14850 | 21005 | ||
5 | B | 801 | 2430 | 3660 | 25000 | 32820 | |
6 | C | 1086 | 2350 | 4620 | 6220 | 38000 | 47261 |
7 | N | 1400 | 2860 | 4580 | 7500 | 9400 | 53000 |
8 | O | 1314 | 3390 | 5300 | 7470 | 11000 | 13000 |
9 | F | 1680 | 3370 | 6050 | 8400 | 11000 | 15200 |
10 | Ne | 2080 | 3950 | 6120 | 9370 | 12200 | 15000 |
Tendenza periodica dell'energia di ionizzazione
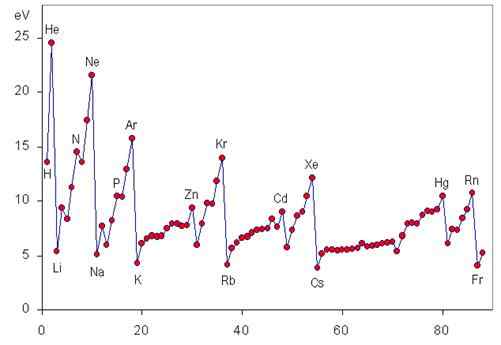
L'energia di ionizzazione è una proprietà periodica che aumenta da sinistra a destra e dal basso alla tabella periodica, come si può vedere nella seguente grafica.
Può servirti: dilatazione lineare: cos'è, formula e coefficienti, esempio
Variazione di I per un periodo
Quando ci muoviamo per un periodo da sinistra a destra, viene progressivamente chiamato progressivamente il carico nucleare effettivo, che non è altro che il vero carico positivo che gli elettroni più esterni possono "vedere" a causa dello scudo degli elettroni più interni.
Ciò significa che la forza con cui il nucleo è in grado di attirare gli elettroni di Valencia sta aumentando, quindi diventa più difficile strapparli e l'energia richiesta (cioè l'energia di ionizzazione) diventa maggiore.
Variazione di I in un gruppo
Quando scendiamo in un gruppo, stiamo posizionando elettroni in aumento dei livelli di energia e, quindi, negli orbitali atomici sempre più lontani dal nucleo. Per questo motivo, la forza con cui il nucleo attira gli elettroni di valenza diminuisce mentre scendiamo in un gruppo, riducendo anche l'energia di ionizzazione.
Come determinare l'energia di ionizzazione?
L'energia di ionizzazione è una quantità sperimentalmente certa attraverso una serie di tecniche chiamate, insieme, spettroscopia di fotoelettroni.
Queste tecniche si basano su un fenomeno molto simile all'effetto fotoelettrico, in cui la radiazione elettromagnetica è in grado di avviare gli elettroni di un atomo e la differenza tra energia di radiazione e energia cinetica con cui viene a fuoco l'energia di ionizzazione.
Le diverse tecniche di spettroscopia di fotoelettroni consentono di analizzare le energie di cui praticamente qualsiasi elettrone è collegato al suo nucleo, sia che un elettrone di Valencia o un elettrone interno.
Esempi di energia di ionizzazione
Prima energie di ionizzazione dei gas nobili
I gas nobili hanno le configurazioni elettroniche più stabili di tutti gli elementi della tabella periodica. Per questo motivo, hanno anche le maggiori energie di ionizzazione. La prima energia di ionizzazione di ciascuno dei gas nobili è presentata di seguito:
-
Elio
La sua prima energia di ionizzazione è 2373 kJ/mol, la più alta nell'intera tavola periodica.
-
Neon
La sua prima energia di ionizzazione è 2080 kJ/mol ed è la seconda più alta.
-
Argon
La sua prima energia di ionizzazione è 1521 kJ/mol. Solo la f, ne e hanno maggiori energie di ionizzazione.
-
Kripton
La prima energia di ionizzazione è 1350 kJ/mol. Non è alto come gli altri, ma è ancora maggiore di quello dei suoi elementi vicini.
-
Xeno
La stessa cosa che si dice del Kripton si può dire dello xeno con la sua prima energia di ionizzazione di 1170 kJ/mol.
Può servirti: worm hole: storia, teoria, tipi, formazioneEnergie di ionizzazione della prima e seconda
I metalli alcalini hanno a sua volta la minima prima energia di ionizzazione e la più grande seconda energia di ionizzazione di tutti gli elementi:
-
Litio
La sua prima energia di ionizzazione è inferiore a un quarto di quella dell'HE, ma il litio ha la più grande seconda energia di ionizzazione di tutti gli elementi, che è 7300 kJ/mol.
-
Sodio
Il sodio perde il suo primo elettrone molto facilmente, poiché acquisisce la configurazione elettronica del NE, ma per eliminare il secondo elettrone è necessario fornire 4560KJ/mol.
-
Potassio
La prima energia di ionizzazione del potassio è solo 418,7 kJ/mol, mentre la seconda è 3052 kJ/mol, considerevolmente maggiore di quella dei suoi vicini.
-
Rubidio
Con un'energia di ionizzazione di 403 kJ/mol, Rubido è uno degli elementi con meno energia di ionizzazione. Tuttavia, il secondo è 2633 kJ/mol.
-
Cesio
La sua prima energia di ionizzazione è solo 375 kJ/mol e la seconda 2234 kJ/mol, persino inferiore alla prima energia di ionizzazione dell'elio.

