Elementi, composti e miscele
- 1407
- 9
- Lino Lombardi
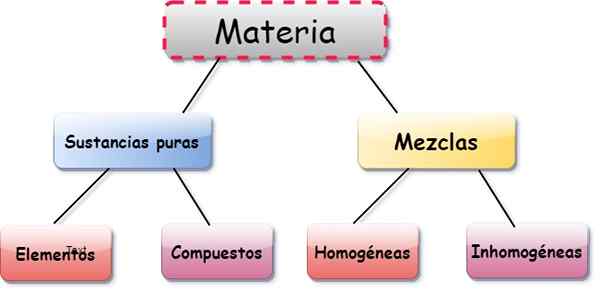
Elementi, composti e miscele sono tre forme di presentazione della materia. IL elementi Sono sostanze costituite da una singola classe di atomo, il composti Sono combinazioni tra due o più elementi e miscele Derivano dalla composizione di diversi elementi e sostanze.
I componenti delle miscele sono separati attraverso mezzi fisici. Da parte sua, per separare gli elementi di un composto, le procedure chimiche devono essere eseguite.
Non c'è modo di separarli in componenti minori con metodi ordinari, ma ci sono modi per gli atomi di fessura. In effetti, la fissione è un modo per estrarre energia da loro.
Gli atomi che compongono un determinato composto lo fanno sempre in proporzioni fisse. Da parte sua, in una miscela le proporzioni dei suoi componenti possono variare. Pertanto, gli elementi e i composti sono considerati sostanze pure, la cui composizione è costante e ben definita.
Ad esempio, il sale da tavola o il cloruro di sodio è un composto a cui partecipano gli atomi di cloro e sodio, in una proporzione di uno per uno. Nel frattempo, il latte è una miscela di composizione variabile, in cui ogni componente mantiene la sua identità.
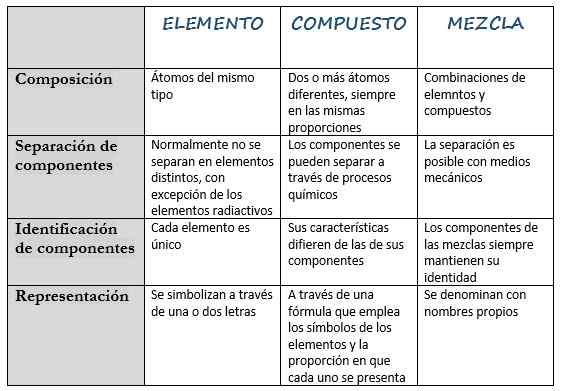
La tabella seguente raccoglie le sue caratteristiche principali:
Elemento | Composto | Mescolare | |
Definizione | Sostanza che non può essere decomposta in altre sostanze più semplici. | Sostanza costituita da due o più elementi diversi. | Sostanza prodotta durante la miscelazione di altre sostanze. |
Composizione | Atomi dello stesso tipo. | Due o più atomi diversi, sempre nelle stesse proporzioni. | Combinazioni di elementi e composti. |
Separazione dei componenti | Normalmente non si separano in diversi elementi, ad eccezione degli elementi radioattivi. | I componenti possono essere separati attraverso i processi chimici. | La separazione è possibile con mezzi meccanici. |
Identificazione dei componenti | Ogni elemento è unico. | Le sue caratteristiche differiscono da quelle dei suoi componenti. | I componenti delle miscele mantengono sempre la loro identità. |
Rappresentazione | Sono simboleggiati in una o due lettere. | Attraverso una formula che utilizza i simboli degli elementi e la proporzione in cui ciascuno viene presentato. | Si chiama con nomi propri. |
Esempi | Idrogeno (H), silicio (sì), elio (he), oro (Au), potassio (K). | Cloruro di sodio (NaCl), ammoniaca (NH3), idruro di sodio (NAH), biossido di azoto (NO2). | Sangue, latte, aria, cemento. |
Elementi
Definizione
Gli elementi sono sostanze pure e semplici, nella cui composizione intervengono solo gli atomi dello stesso tipo. Il comportamento chimico di ciascun elemento è caratteristico e non ci sono due uguali, sebbene ci siano caratteristiche comuni tra gruppi di elementi.
Può servirti: iodometria: basi, reazioni, procedura generale, usiNon è possibile decomporre un elemento in uno più semplice, ad eccezione di procedure speciali, come Bombard.
Il processo di disintegrazione si verifica spontaneamente in alcune sostanze come la radio, alcune varietà di uranio, torio e altri elementi chiamati radioattivi.
Composizione
Gli elementi sono formati da atomi identici. Questi, a loro volta, sono costituiti da tre tipi di particelle: elettroni, protoni e neutroni. Elettroni e protoni hanno rispettivamente massa elettrica, negativa e positiva. I neutroni hanno massa, ma non caricano.
L'atomo è costituito da un nucleo atomico formato da protoni e neutroni, mentre gli elettroni sono distribuiti in orbitali intorno a loro. Un elemento si distingue da un altro dal numero di protoni che il suo nucleo ha, chiamato numero atomico.
Mentre questo rimane costante, è lo stesso elemento, anche se il numero di neutroni ed elettroni cambia, poiché in quel caso il isotopi.
Identificazione dei componenti
Vengono utilizzate tecniche diverse e complesse, ad esempio, per "vedere" gli elettroni dell'atomo ci sono microscopi speciali, come il microscopio dell'effetto tunnel.
Tecnica di separazione
L'atomo di un elemento non è separato attraverso metodi chimici, ma è bombardata da particelle più piccole, di solito neutroni, in un processo chiamato fissione nucleare. Ma, sebbene in teoria ogni atomo sia fisicamente, è più facile farlo con atomi che hanno nuclei pesanti, come l'uranio-235.
Tipi di elementi
Ci sono 118 elementi, situati nella tavola periodica, ordinati per numero atomico. Di questi, 92 si trovano in natura e quelli rimanenti sono ottenuti in laboratorio.
Può servirti: carbonio amorfo: cosa è, tipi, proprietà, usiSono distribuiti in tre gruppi:
- Metalli, con elettroni liberi che li rendono buoni conduttori di calore ed elettricità, quasi sempre solidi (tranne il mercurio) e alta densità.
- Nessun metallo, mancanza di proprietà di condotta, sono presentati in uno stato solido o gassoso, tranne il bromo, e la loro densità è inferiore.
- Metalloidi, elementi con caratteristiche intermedie tra metalli e non metalli.
Rappresentazione grafica
Ogni elemento della tabella periodica è simboleggiato con lettere. Ad esempio, H, O, C e Fe corrisponde rispettivamente all'idrogeno, all'ossigeno, al carbonio e al ferro.
Esempi di elementi
Oltre a quelli menzionati, ci sono i seguenti elementi, con il loro simbolo tra parentesi:
- Cloro (CL)
- Mercurio (HG)
- Fosforo (P)
- Iodio (i)
- Magnesio (mg)
Composti
Definizione
I composti sono sostanze pure, la cui composizione due o più tipi di atomi diversi sono coinvolti, in alcune proporzioni, per formare molecole. I sindacati tra gli atomi vengono eseguiti da collegamenti, che sono un fattore determinante nelle proprietà composte.
I collegamenti principali sono:
- Ionico
- Metallo
- Covalente
Composizione
I composti sono costituiti da due o più tipi di atomi, sempre in proporzione fissa.
Identificazione dei componenti
Ogni composto ha proprietà che lo rendono unico, che differiscono da quelle dei suoi elementi costituenti, perché perdono la loro identità formando il composto. Ad esempio, a temperatura ambiente idrogeno e ossigeno sono gas, che, se combinati, danno origine all'acqua.
Tecnica di separazione
Normalmente i composti sono separati da reazioni chimiche, sebbene le radiazioni elettromagnetiche, compresa la luce, siano anche in grado di dissociarsi le molecole.
Tipi di composti
I composti sono divisi in due categorie principali:
- Inorganico
- Biologico
La differenza è che i composti organici si basano sull'elemento di carbonio, quando forma collegamenti di tipo covalente con idrogeno. Il carbonio partecipa allo stesso modo in molti composti inorganici, formando altri collegamenti.
Rappresentazione grafica
Viene fatto attraverso la sua formula chimica, in cui sono specificati i suoi componenti, con il rispettivo simbolo e la proporzione a cui partecipano. I composti hanno anche vari nomi.
Esempi di composti
- Cloruro di sodio o sale da tavola (NaCl)
- Bicarbonato di sodio (Nahco₃)
- Ammoniaca (NH3)
- Carbonato di calcio (Caco3)
- Glucosio (c₆h₁₂o₆)
Miscele
Definizione
Combinazione di due o più elementi e/o composti, senza proporzioni definite, ciascuna mantenendo la propria identità, cioè senza che le loro proprietà cambino quando fanno parte della miscela.
Composizione
È variabile.
Identificazione dei componenti
È più semplice da eseguire, perché i componenti mantengono la loro identità.
Tecnica di separazione
I componenti di una miscela possono essere separati con un metodo fisico o meccanico, come il filtro o la centrifugazione, ad esempio.
Tipi di miscele
Le miscele sono classificate come:
- Omogeneo: le particelle componenti sono indistinguibili, nonostante siano di diverse sostanze. Ad esempio, zucchero molto disciolto in acqua.
- Eterogeneo: miscele in cui le particelle si distinguono, anche ad occhio nudo, come sabbia e sale o sale miscelato con file metalliche.
Rappresentazione grafica
Le miscele mancano di una formula definita, ma molti hanno i loro nomi.
Esempi di miscele
- Cemento
- Ketchup
- Legna
- Aria
- Latte
- Calcestruzzo
- Sangue

