Elettroni interni

- 3203
- 517
- Brigitta Ferrari
Spieghiamo quali sono gli elettroni interni, le loro caratteristiche e diamo diversi esempi
Cosa sono gli elettroni interni?
Ogni volta che pensiamo a un atomo, immaginiamo un nucleo formato da protoni e neutroni, circondato da elettroni che ruotano attorno ad esso, simili a come i pianeti ruotano attorno al sole.
Ma non tutti gli elettroni sono gli stessi e due classi possono essere distinti, a seconda di quanto siano vicini o lontani dal nucleo atomico.
Alcuni sono più lontani dal nucleo e sono chiamati elettroni Valencia. Questi sono responsabili di tutte le reazioni chimiche che conosciamo. D'altra parte, Coloro che sono più vicini al nucleo e sono più fortemente uniti, sono quelli che chiamiamo elettroni interni.
Caratteristiche degli elettroni interni
Sono gli elettroni più stabili
Come regola generale, più basso è il livello di energia di un elettrone, questo è più stabile. Gli elettroni interni occupano orbitali ai livelli di energia più bassi di un atomo, quindi sono anche gli elettroni più stabili.
Sono più fortemente uniti al nucleo
Il nucleo attira elettroni perché entrambi hanno carichi opposti: il nucleo è positivo mentre gli elettroni negativi. Questa forza aumenta quando la distanza diminuisce.
Come conseguenza di ciò, gli elettroni interni, che sono quelli più vicini al nucleo, sono anche quelli che sono più fortemente legati allo stesso. Per lo stesso motivo, sono anche gli elettroni più difficili da rimuovere.
Non fanno parte dei legami chimici
Quando un atomo si avvicina a un altro, la prima cosa da toccare sono i loro elettroni più esterni. Per questo motivo, solo gli elettroni di Valencia intervengono nelle reazioni chimiche. Gli elettroni interni né partecipano a legami chimici, né sono coinvolti in alcuna reazione chimica.
Può servirti: quanti elettroni di custodia hanno il carbonio?Sono molto protetti
Ciò significa che gli elettroni interni si trovano tra elettroni esterni e nucleo, creando una sorta di schermo che riduce la forza con cui il nucleo attira gli elettroni di valenza.
Vengono sempre in coppia
In ogni orbitale ci sono solo due elettroni con giri opposti, che sono chiamati elettroni accoppiati (che è un altro modo per dire che formano un paio). Come gli orbitali in cui si trovano gli elettroni interni, sono sempre completamente pieni, quindi questi elettroni sono sempre accoppiati.
Come facciamo a sapere quanti elettroni interni ha un atomo?
Sapere quanti elettroni interni hanno un atomo è molto semplice. Devi solo sapere quanti elettroni ha l'atomo e quanti di questi elettroni appartengono allo strato di Valencia. Tutti gli altri elettroni sono elettroni interni.
Ma come scopriamo questi numeri? Nelle sezioni seguenti lo spieghiamo.
Il numero totale di elettroni è uguale al numero atomico
Poiché gli atomi sono neutri (cioè non hanno carica elettrica netta), devono avere lo stesso numero di carichi positivi (protoni) dei carichi negativi (elettroni). Poiché il numero atomico indica quanti protoni ci sono nel nucleo, quindi indica anche quanti elettroni è un atomo quando è neutro.
Nel caso degli ioni, che a differenza degli atomi hanno una carica elettrica, il numero totale di elettroni viene ottenuto sottraendo il numero atomico tranne il carico di ioni, con tutto e il loro segno.
Esempi
- L'atomo di carbonio (c) è il numero 6 della tabella periodica (che è il suo numero atomico). Pertanto, l'atomo di carbonio ha 6 elettroni in totale.
- Lo ione di sodio (i) (na+) ha una carica positiva di +1 e il numero atomico di sodio è 11. Quindi il numero totale di elettroni di questo ione è: 11 - (+1) = 10 elettroni.
- Lo ione cloruro (CL-) ha un carico negativo di -1 e il numero atomico di cloro è 17. Quindi il numero totale di elettroni di questo ione è: 17 - ( - 1) = 17 + 1 = 18 elettroni.
Il numero di elettroni di Valencia è uguale al loro gruppo nella tabella periodica
Gli elementi che appartengono al gruppo 1A (i metalli alcalini) hanno tutti 1 elettrone di Valencia. Quelli che appartengono al 2 ° (Alkaliner) hanno 2, quelli del 3 ° (gruppo boro, alluminio, gallio, ecc.) Hanno 3 e così via. Questo non si applica ai metalli di transizione.
Come prima, gli ioni vengono sottratti dal calcolo dei loro elettroni di valenza.
Esempi
- L'ossigeno appartiene al gruppo 6a per quello che ha 6 elettroni di valenza.
- Lo ione solfuro (s2-) Appartiene anche al gruppo 6a, ma ha un carico di -2, quindi ha: 6 -( -2) = 6 + 2 = 8 Electron di Valencia.
Esempi di atomi diversi e dei loro elettroni interni
Elettroni di carbonio interni (C)

Come abbiamo visto un momento fa, il carbonio ha 6 elettroni in totale. Inoltre, appartiene al gruppo 4A per quelli che hanno 4 elettroni di Valencia, quindi ha, in totale 6 - 4 = 2 elettroni interni.
Elettroni di azoto interni (N)
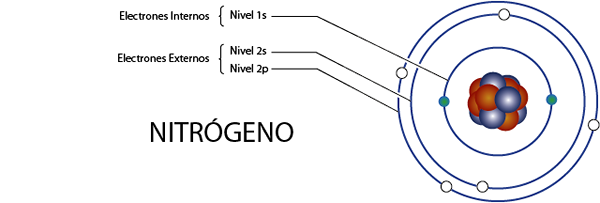
L'azoto ha 7 elettroni in totale. Inoltre, appartiene al gruppo 5A per quelli che hanno 5 elettroni di Valencia, quindi ha, in totale 7 - 5 = 2 elettroni interni.
Elettroni interni di Argon (AR)
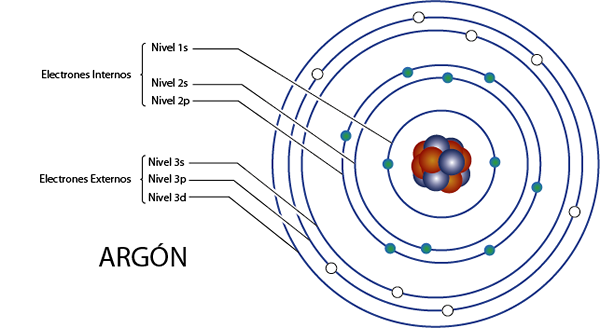
Argon è l'elemento 18 per quello che ha 18 elettroni in totale. Inoltre, appartiene al Gruppo 8A per quelli che hanno 8 elettroni di Valencia, quindi ha, in totale 18 - 8 = 10 elettroni interni.
Elettroni interni dello ione cloruro (CL-)
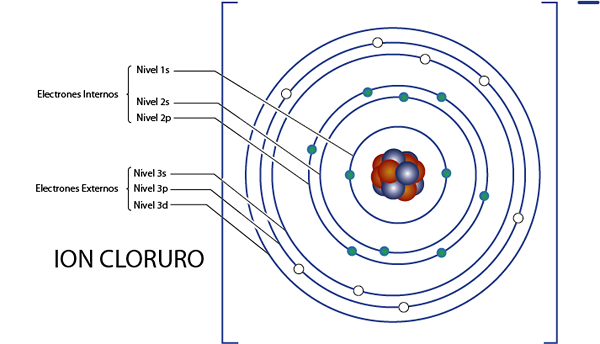
Come abbiamo visto un momento fa, il cloruro ha 18 elettroni in totale. Inoltre, appartiene al gruppo 7a e ha carico -1, quindi ha 7 - ( - 1) = 8 elettroni Valencia. Quindi ha 18 - 8 = 10 elettroni interni, Come Argon.
Può servirti: chimica nucleare: storia, campo di studio, aree, applicazioniElettroni interni di calcio +2 ione (CA2+)
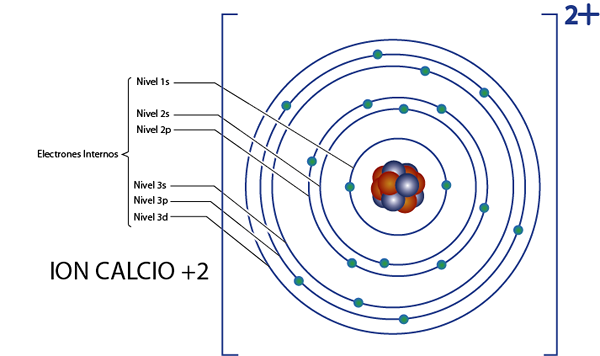
Il calcio è l'elemento 20 e questo ione ha 2 cariche positive, quindi ha un totale di 20 - 2 = 18 elettroni intorno al nucleo. Questo elemento appartiene al gruppo 2a e poiché il suo carico è +2, quindi non ha elettroni di valenza (2 - 2 = 0). Per questo motivo, tutti i 18 elettroni rimasti dal calcio sono quelli che erano originariamente gli elettroni interni.
Ci sono due elementi che non hanno elettroni interni
I due elementi più leggeri della tavola periodica, che sono idrogeno (H) ed elio (HE), hanno solo 1 e 2 elettroni rispettivamente. Entrambi gli elettroni sono all'unico livello di energia che hanno questi atomi, che è il livello 1.
Per questo motivo, questi elettroni corrispondono agli elettroni di valenza di questi due elementi. Poiché non ci sono livelli di energia inferiori, allora non ci sono anche elettroni interni.

