Struttura einsenio (s), proprietà, ottenimento, usi

- 1038
- 31
- Lino Lombardi
Lui Einstenio È un elemento chimico che appartiene alla classe di actinidi o actinoidi. Il suo numero atomico è 99 ed è rappresentato dal simbolo è. È un elemento sintetico, poiché non è stato trovato in alcun materiale minerale o terrestre. Fu scoperto nel 1952 nei resti del primo test di esplosione della pompa idrogeno.
Gli actinoidi sono una serie il cui primo membro è l'actinio e fanno parte delle chiamate Elementi di transizione interna. Einsenio è anche il settimo elemento transurico, poiché sette posti si trovano più tardi di uranio nella tavola periodica degli elementi.
 Simbolo, numero atomico e massa atomica standard di Einsenio. ME/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/2.5). Fonte: Wikimedia Commons.
Simbolo, numero atomico e massa atomica standard di Einsenio. ME/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/2.5). Fonte: Wikimedia Commons. È un solido molto radioattivo e una volta formato inizia a disintegrarsi formando altri elementi, il che ha reso molto difficile studiarlo. Sebbene il numero di possibili isotopi di Einsenio sia grande, è stato scoperto solo meno del 20%.
Einsenio non ha usi commerciali. È prodotto in quantità molto ridotte nei laboratori nucleari ed è destinato solo a esperimenti scientifici. Inoltre, i ricercatori di tali saggi lo usano in pochissimi microgrammi e con precauzioni dovute, poiché l'esposizione alla loro radiazione è letale.
[TOC]
Nomenclatura
- Einsenio, simbolo chimico: lo è
- Einstenio-253, ES-253 o 253È: isotopo Einsenio con una massa atomica di 253.
Scoperta
Origine
Questo elemento fu identificato per la prima volta da Albert Ghiorso (scienziato nucleare degli Stati Uniti) e dai loro collaboratori nel dicembre 1952 in frammenti dispersi dall'esplosione termonucleare del primo test della pompa di idrogeno.
Questa bomba H, chiamata "Ivy Mike" e anche "La Salachicha" per la sua forma, è stata fatta esplodere nel novembre dello stesso anno su un'isola appartenente a un atollo di coralli del Pacifico.
 Ivy Mike Hydrogen Pump Explosion. O.S. Dipartimento dell'Energia / Dominio pubblico. Fonte: Wikimedia Commons.
Ivy Mike Hydrogen Pump Explosion. O.S. Dipartimento dell'Energia / Dominio pubblico. Fonte: Wikimedia Commons. Per farla esplodere era stata utilizzata una pompa di fissione dell'uranio. Gli atomi di quest'ultimo hanno catturato diversi neutroni durante l'esplosione e hanno subito vari passi del decadimento beta, in ognuno dei quali viene emesso un elettrone e un protone, il che ha portato alla formazione di Einstenio-253, un isotopo dell'ES.
Un isotopo è una variante dello stesso elemento che ha un numero diverso di neutroni nel nucleo dell'atomo, quindi ha lo stesso numero atomico (in questo caso 99) ma massa atomica diversa. Il numero di isotopi indica la sua massa atomica.
Può servirti: Triossido di zolfo (SO3): struttura, proprietà, rischi, usiPubblicazione della scoperta
Inizialmente il lavoro fu tenuto segreto, ma dopo un anno gli autori decisero di pubblicarlo per paura che altri scienziati indipendenti potessero produrlo in altri laboratori, ottenere il merito della scoperta e assegnare il nome all'elemento.
Quindi da novembre 1953 a marzo 1954 hanno riportato quattro dei loro isotopi. Finalmente nell'estate del 1955 fu annunciata la scoperta del nuovo elemento Einsenio con il numero atomico 99.
 I nuclei degli atomi hanno protoni e neutroni. Gli isotopi di un elemento sono atomi dello stesso che hanno un numero diverso di neutroni nel loro nucleo. Autore: Gerd Altmann. Fonte: Pixabay.
I nuclei degli atomi hanno protoni e neutroni. Gli isotopi di un elemento sono atomi dello stesso che hanno un numero diverso di neutroni nel loro nucleo. Autore: Gerd Altmann. Fonte: Pixabay. È importante notare che la raccolta dei campioni dell'esplosione termonucleare ha rivendicato la vita del primo tenente Jimmy Robinson, che era esposto alle radiazioni di questi.
Selezione del nome
Il nome di "Einsenio" è stato scelto perché Albert Einstein ha gettato alcune delle basi della teoria quantistica che avrebbe quindi spiegato come gli atomi interagiscono tra loro.
La cosa più significativa della presenza del suo nome è l'applicazione della sua famosa equazione e = mc2, che spiega la conversione della massa in energia nelle armi più distruttive create dall'essere umano.
 Albert Einstein non era d'accordo con l'uso della scienza per creare armi distruttive. Autore: Stux. Fonte: Pixabay.
Albert Einstein non era d'accordo con l'uso della scienza per creare armi distruttive. Autore: Stux. Fonte: Pixabay. Gli autori della scoperta hanno suggerito che l'elemento avesse il simbolo "E", ma nel 1957 l'Unione internazionale della chimica pura e applicata, o Iupac (acronimo di inglese Unione Internazionale di chimica pura e applicata), ha cambiato il simbolo in "is".
Struttura elettronica
La sua configurazione elettronica è:
1S2; 2S2 2P6; 3S2 3P6 3D10; 4S2 4P6 4D10 4F14; 5S2 5P6 5D10; 6S2 6P6; 5Fundici 7S2,
o riassunto:
[RN] 5Fundici 7S2,
dove [RN] è la struttura elettronica del gas di radon nobile (che è anche radioattivo).
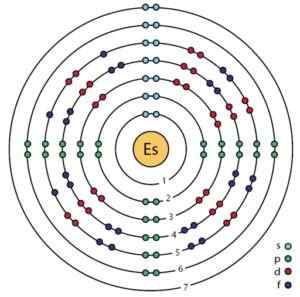 Schema degli orbitali e degli elettroni di un atomo di Einsenio, secondo un modello BOHR migliorato. Rasatura.Sciencewer/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0). Fonte: Wikimedia Commons.
Schema degli orbitali e degli elettroni di un atomo di Einsenio, secondo un modello BOHR migliorato. Rasatura.Sciencewer/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0). Fonte: Wikimedia Commons. Proprietà Einsenio
Stato fisico
Solido metallico a temperatura ambiente.
Può servirti: nitrato d'argento (agno3): struttura, proprietà, usi, tossicitàMassa atomica
252.083
Punto di fusione
860 ºC
Punto di ebollizione
996 ºC
Proprietà chimiche
Studi con 253Sta dimostrando che il loro comportamento è quello che è generalmente osservato in un elemento di recitazione trivalente, cioè nelle sue reazioni predomina Valencia +3.
Alcuni composti con stato di ossidazione +3 sono stati caratterizzati, come il cloruro (SCL3), Bromuro (ESBR3), Yoduro (ESI3), ossicloruro (esocl) e ossido (è2O3).
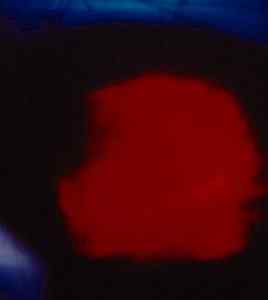 Immagine di Eintenio Yoduro scattata al buio. La luce è causata dall'emissione di radioattività. Il laboratorio nazionale Alamos. / Dominio pubblico. Fonte: Wikimedia Commons.
Immagine di Eintenio Yoduro scattata al buio. La luce è causata dall'emissione di radioattività. Il laboratorio nazionale Alamos. / Dominio pubblico. Fonte: Wikimedia Commons. Tuttavia, sono state riportate anche Valences +2 e +4, sebbene non siano state confermate. In questo caso sarebbe il primo metallo bivalente della serie Actinid.
I dati cristallografici di raggi X di questo elemento e i suoi composti sono molto difficili da ottenere perché la sua disintegrazione spontanea produce radiazioni gamma e raggi X che sovraespongono il rilevatore dello strumento e il film.
Isotopi
Finora sono stati scoperti 19 isotopi di ES con masse atomiche tra 241 e 257 e 3 isomeri. Nessuno è stabile. Tuttavia, di tutti i possibili isotopi Einsenio sono stati prodotti e identificati meno del 20%.
Il suo isotopo più stabile è Eintenio-252, che ha un'emivita di 471,7 giorni. Berkelio-248 si disintegra attraverso l'emissione di una particella alfa (formata da 2 protoni e 2 neutroni) o diventa California-252 catturando un elettrone.
Ottenimento di corrente
Oggi Einsenio è prodotto da una lunga catena di reazioni nucleari che comporta il bombardamento di ogni isotopo a catena con neutroni e alla fine l'isotopo risultante soffre di decadimento beta.
Nel decadimento o nella deintegrazione beta il nucleo dell'atomo emette una particella beta, che può essere un elettrone o un positrone, per bilanciare il rapporto neutrone/protoni nel nucleo dell'atomo.
Procedura
Negli Stati Uniti Oak Ridge Laboratories ci sono Reattore isotopico ad alto flusso). Un microgramma è il milionesimo di un grammo, cioè equivalente a 0,000001 grammi.
Può servirti: tiolleIl metodo è stato il seguente:
- Per diversi anni grandi quantità (chilogrammi) di 239PU (Polonio-239) per produrre 242Pu.
- IL 242PU nell'ossido di plutonio e miscelato con ossido di alluminio al2O3 Per formare sfere compresse.
- Le sfere del materiale sono state incorporate in bar speciali da irradiate per un anno nella pianta del fiume Savannah negli Stati Uniti.
- Quindi le barre sono state irradiate nell'HFIR per altri 4 mesi.
- Infine, il materiale risultante è stato sottoposto a procedure chimiche per separare l'Einstenio dagli isotopi californiali (figli degli ES).
 Nucleo di un atomo. I nuclei di polonio sono bombardati con neutroni come parte della procedura per ottenere Einsenio. Autore: clker-free-vector-images. Fonte: Pixabay.
Nucleo di un atomo. I nuclei di polonio sono bombardati con neutroni come parte della procedura per ottenere Einsenio. Autore: clker-free-vector-images. Fonte: Pixabay. Nelle operazioni speciali dell'HFIR possono essere ottenuti fino a circa 2 milligrammi (mg) di Einsenio.
Applicazioni
Questo elemento si è verificato solo in quantità molto piccole, è anche molto radioattivo, quindi non ha alcun uso commerciale. Attualmente ha un'applicazione solo nella ricerca scientifica di base.
Nell'ottenere Mendelevio
Nel 1961 una quantità macroscopica di 253È con un peso di 0,01 microgrammi (μg) misurato con uno speciale equilibrio magnetico. Questo campione è stato quindi bombardato con neutroni per produrre l'elemento mendelevio (numero atomico 101).
Negli studi sugli effetti delle radiazioni
L'emissione di radiazione einsenio intensa può essere utilizzata per studiare l'invecchiamento accelerato e il danno esercitati dalle radiazioni.
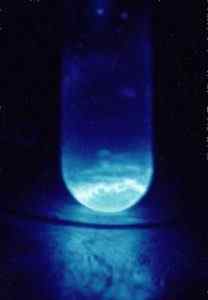 Radiazioni emesse da Einsenio-253. Foto scattata al buio. HAIRE, r. G., Dipartimento dell'Energia degli Stati Uniti.Ritoccato da materialscientist a in.Wikipedia. / Dominio pubblico. Fonte: Wikimedia Commons.
Radiazioni emesse da Einsenio-253. Foto scattata al buio. HAIRE, r. G., Dipartimento dell'Energia degli Stati Uniti.Ritoccato da materialscientist a in.Wikipedia. / Dominio pubblico. Fonte: Wikimedia Commons. Ad esempio, è stato utilizzato negli studi sulle conseguenze chimiche della disintegrazione radioattiva.
A causa dell'emivita relativamente breve di ES-253 (20,47 giorni), è possibile studiare sia la crescita interna del suo Sonnotopo Son BK-249, la cui emivita è di 330 giorni, sia quella del nipote CF-249 (vita media di 351 anni).
Alcuni dati suggeriscono che è un bivalente potrebbe diminuire a un divalente divalente caliporno (ancora sconosciuto).
In studi chimici e fisico
È l'elemento più pesante con cui gli studi possono essere condotti che consentono lo sviluppo di ricerche fondamentali sul ruolo che elettroni 5F Nell'organizzazione e nella classificazione degli actinidi.
ES-252 è disponibile solo in quantità minime. Gli isotopi ES-253 (emivita 20,47 giorni) ed ES-254 (275,7 giorni) hanno un'emivita più lunga e ne hanno una maggiore disponibilità, quindi sono usati in studi fisico.
Tuttavia, solo pochi microgrammi (μg) vengono utilizzati negli esperimenti per ridurre l'esposizione dei lavoratori e ridurre al minimo gli effetti dell'intensa autoradiazione.
 Einsenio è molto pericoloso perché è un elemento fortemente radioattivo. Autore: clker-free-vector-images. Fonte: Pixabay.
Einsenio è molto pericoloso perché è un elemento fortemente radioattivo. Autore: clker-free-vector-images. Fonte: Pixabay. Potenziale uso in medicina
Si stima che possa essere utilizzato per i trattamenti medici di radiazione rivolti a determinati organi.
Riferimenti
- Piombo, d.R. (Editor) (2003). Manuale CRC di chimica e fisica. 85th CRC Press.
- PUBCHEM (2020). Einsteinium - è (elemento). Recuperato da Pubchem.NCBI.Nlm.NIH.Gov.
- Cotone, f. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- Meierfrankenfeld, d. et al. (2011). Scoperta di isotopi di scandium, titanio, mercurio ed einsteinium. Dati atomici e tabelle di dati nucleari 97 (2011) 134-151. Recuperato da ScienceDirect.com.
- Royal Society of Chemistry. (2020). Einsteinium. RSC recuperato.org.
- Ross, r. (2017). Fatti su Einsteinium. Recuperato da LivesCience.com.
- « Caratteristiche ed esempi delle aziende miste
- Caratteristiche del mercato target, tipi, come definirlo, esempi »

