DimEtilammina ((CH3) 2NH) Struttura, proprietà, usi, rischi
- 3426
- 639
- Brigitta Ferrari
IL dimetilammina È un composto organico formato da due gruppi metilici -C3 United to a -nh Group. La sua formula chimica è (Cho3)2NH. È un gas incolore. Quando un odore di pesce viene percepito nell'aria a basse concentrazioni. Tuttavia, se è ad alta concentrazione, ha un odore di ammoniaca NH3.
La dimetilammina è presente nelle piante e negli animali. Si ritiene che nell'essere umano provenga dalla decomposizione di alcuni enzimi ma anche dall'ingestione di alcuni alimenti come i pesci. Se il gas dimetilammina si dissolve in acqua, forma soluzioni molto alcaline e corrosivi.
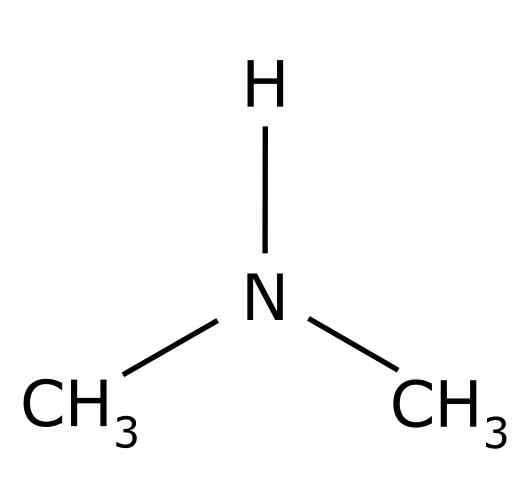
 Dimetilammina. Ring0 [dominio pubblico]. Fonte: Wikimedia Commons.
Dimetilammina. Ring0 [dominio pubblico]. Fonte: Wikimedia Commons. Ha vari usi industriali come produrre solventi, per accelerare la vulcanizzazione della gomma.
La dimetilamina è un gas molto infiammabile. I contenitori che lo contengono non dovrebbero essere esposti al calore o al fuoco in quanto possono sfruttare. Inoltre, i loro vapori sono occhi irritanti, pelle e tratto respiratorio.
È un composto che può far parte degli aerosol atmosferici, cioè di goccioline molto sottili che si trovano nell'atmosfera.
[TOC]
Struttura
La dimetilamina è un'ammina alifatica secondaria. Ciò significa che i sostituenti di azoto (N) sono alifatici (-Ch3), il che significa che non sono aromatici e che sono due. Pertanto ci sono due metil -ch3 United Azoto, che ha anche un idrogeno (H).
Nella molecola di dimetilammina, l'azoto (N) ha una coppia di elettroni liberi, cioè un paio di elettroni che non sono uniti a nessun altro atomo.
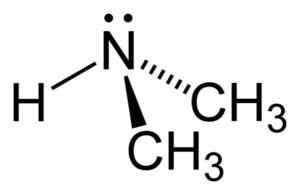 Struttura della dimetilammina. Autore: Benjah-BMM27. Fonte: Wikimedia Commons.
Struttura della dimetilammina. Autore: Benjah-BMM27. Fonte: Wikimedia Commons. Nomenclatura
- Dimetilammina
- N, N-dimetilammina
- N-metilmetanamina
- DMA (acronimo per di-metil-amine).
Proprietà
Stato fisico
Gas incolore.
Peso molecolare
45,08 g/mol
Punto di fusione
-93 ºC
Punto di ebollizione
7,3 ºC
Punto d'infiammabilità
-6,69 ºC (metodo di coppa chiusa).
Temperatura di autorezione
400 ° C
Può servirti: legge di più proporzioniDensità
Liquido = 0,6804 g/cm3 A 0 ºC.
Vapore = 1,6 (densità relativa rispetto all'aria, aria = 1).
Solubilità
Molto solubile in acqua: 163 g/100 g di acqua a 40 ° C. Solubile in etanolo ed etere etilico.
ph
Le soluzioni di dimetilammina acquose sono fortemente alcaline.
Costante di dissociazione
KB = 5.4 x 10-4
PkA di acido coniugato = 10.732 a 25 ° C. L'acido coniugato è lo ione dimetilamone: (Cho3) Nh2+
Proprietà chimiche
La dimetilammina liquida può attaccare alcune materie plastiche, pneumatici e rivestimenti.
Quando si dissolve in acqua, la coppia di elettroni senza azoto (N) prende un protone (H+) di acqua, lasciando un oh libero-, Quindi forma soluzioni molto alcaline e corrosive:
Dimetilammina + acqua → ione dimetilamone + ione idrossile
(Ch3)2NH + H2O → (scegli3)2NH2+ + OH-
Con l'acido nitrico si ottiene un sale di nitrato, cioè nitrato di dimetila amotilamonium:
Dimetilammina + acido nitrico → dimetilamonium nitrato
(Ch3)2NH +HNO3 → (Ch3)2NH2+NO3-
Altre proprietà
Quando in bassa concentrazione di aria ha un odore simile ai pesci, mentre ad alte concentrazioni odora di ammoniaca (NH3).
Reazioni biochimiche
Nell'organismo, la dimetilammina può soffrire di nitrillare in condizioni debolmente acide per dare una dimetilnitrosamina un composto cancerogeno (CH3)2N-no.
La formazione di dimetlnitrosamina si verifica da dimetilammina e nitrito (nitrito di sodio) nello stomaco (un pH 5-6) mediante azione dei batteri esistenti nel tratto gastrointestinale. Il nitrito di sodio è presente in alcuni alimenti.
Dimetilammina + nitrito di sodio → dimetilnitrosamina + idrossido di sodio
(Ch3)2NH + Nano2 → (Ch3)2N-no + naoh
Ottenimento
La dimetilamina viene preparata commercialmente reagendo il metanolo (scegli3Oh) con ammoniaca (NH3) a 350-450 ° C in presenza di un catalizzatore di silice-allumina (SIO2/Al2O3).
2 ch3Oh + NH3 → (Ch3)2NH + 2 h2O
Poiché vengono prodotte anche la monometilammina e la trimetilammina, una purificazione viene eseguita in una serie di quattro a cinque colonne di distillazione.
Presenza in natura
La dimetilammina si trova nelle piante e negli animali. È anche presente in modo naturale e abbondante nelle urine umane.
Può servirti: epossido: nomenclatura, ottenimento, applicazioni, esempiSi stima che la sua presenza nell'uomo sia dovuta al fatto che alcuni tipi di batteri intestinali sono prodotti da alcuni composti trovati negli alimenti.
Alcuni di questi composti sono la collina (composto associato al gruppo B) e ossido di trimetilammina. Si ritiene inoltre che provenga da un inibitore enzimatico dell'ossido nitrico (NO) che si forma nel corpo.
Alcune fonti di informazione indicano che l'aumento della dimetilammina nelle urine è causato dall'ingestione di pesci e frutti del mare, dove si ottengono valori principali quando mangiano calamari, bile, sardine, pesce spada, merluzzo, pesce e linea.
 Mangiare pesce potrebbe aumentare i livelli di dimetilammina nelle urine. Autore: Anna Sulincha. Fonte: Pixabay.
Mangiare pesce potrebbe aumentare i livelli di dimetilammina nelle urine. Autore: Anna Sulincha. Fonte: Pixabay. Pazienti con dimetilammina in eccesso
Si ritiene che la dimetilammina sia una tossina uremica, cioè una sostanza che può causare danni se la sua concentrazione nelle urine viene sollevata. In effetti, sono stati osservati livelli molto elevati di dimetilammina nei pazienti con malattia renale nello stadio terminale.
Si ritiene che in questi pazienti potrebbe esserci una sovrappopolazione di batteri intestinali che potrebbero produrrelo.
Applicazioni
DMA o DMA è usato per:
- Preparazione di altri composti.
- Produzione di solventi dimetilformamide e dimetilacetamide.
- Accelerare la vulcanizzazione di alcune gengive.
- Elimina i capelli durante l'abbronzatura.
- Agire come antiossidante per i solventi.
- Servire come agente di flottazione minerale.
- Inibire la corrosione e come agente anti -sniff.
- Funzionare come tensioattivo.
- Fare saponi e detergenti.
- Agisci come chimico nei tessuti.
- Funzionare come agente anti -daggio nei carburanti e come stabilizzatore a gas.
- Preparare i coloranti.
- Assorbire i gas acidi.
- Servire come pesticidi e razzi.
- Essere parte degli agenti per il trattamento delle acque.
- Fungere da fungicida nei prodotti agrochimici.
- Usi già interrotti come attrarre e sterminare gorgjos o insetti che attaccano il cotone.
 Pianta di cotone. Autore: Isaa KC. Fonte: Pixabay.
Pianta di cotone. Autore: Isaa KC. Fonte: Pixabay.  In passato gli insetti che attaccano le piante di cotone sono stati eliminati con dimetilammina. Marvinbikolano [CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikimedia Commons.
In passato gli insetti che attaccano le piante di cotone sono stati eliminati con dimetilammina. Marvinbikolano [CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikimedia Commons. Rischi
I vapori di dimetilamina sono la pelle irritante, gli occhi e il tratto respiratorio.
Può servirti: composti inorganiciSe si entra in contatto con la pelle in forma liquida può causare congelamento e bruciatura chimica. La sua inalazione ha effetti negativi per la salute.
Il gas DMA è corrosivo e può formare soluzioni acquose corrosive. Le tue soluzioni acquose possono diventare infiammabili a meno che non siano abbastanza diluite.
La dimetilammina a forma di gas è facilmente infiammata producendo fumi tossici di ossidi di azoto (noX).
Se il contenitore contenente questo gas è esposto a calore o calore intenso, può esplodere.
Influenza del DMA nell'atmosfera
L'aerosol atmosferico (goccioline molto piccole di miscela di composti naturali e/o inquinanti nell'atmosfera) ha un profondo impatto sul clima globale e sulla qualità dell'aria nelle varie regioni del mondo.
La formazione di nuove particelle di aerosol non è ancora completamente compresa.
Si stima che la dimetilammina partecipi insieme ad altri composti nella formazione di queste particelle, che sembra dipendere dall'area delle forti emissioni di DMA.
Ad esempio, nelle aree industriali c'è una maggiore concentrazione rispetto alle aree agricole, e questo può influenzare il modo in cui la DMA partecipa.
Va notato che, secondo alcuni scienziati, la combustione di materiale vegetale contenente glifosato (uno degli erbicidi che è più utilizzato nel mondo) può portare a formazione di dimetilammina.
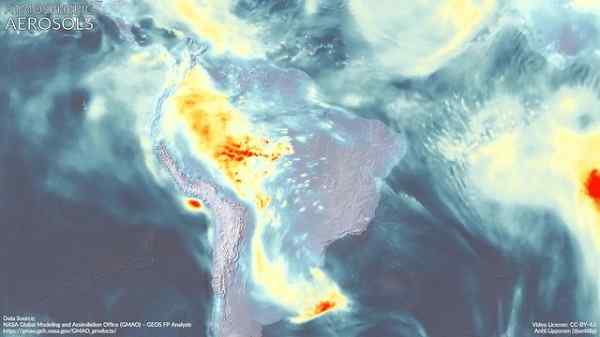 Aerosol atmosferici in Sud America. La dimetilamina potrebbe contribuire alla sua formazione. Marvinbikolano [CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikimedia Commons.
Aerosol atmosferici in Sud America. La dimetilamina potrebbe contribuire alla sua formazione. Marvinbikolano [CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikimedia Commons. Riferimenti
- O.S. Biblioteca nazionale di medicina. (2019). Dimetilammina. Recuperato da Pubchem.NCBI.Nlm.NIH.Gov.
- Kirk-Othmer (1994). Enciclopedia della tecnologia chimica. Quarta edizione. John Wiley & Sons.
- Morrison, r.T. e boyd, r.N. (2002). Chimica organica. 6a edizione. Prentice-Hall.
- Windholz, m. et al. (Redattori) (1983). L'indice Merck. Un eniclopedia di sostanze chimiche, farmaci e biologici. Decima edizione. Merck & co., INC.
- Abramowitz, m.K. et al. (2010). La fisiopatologia dell'uremia. Ammine alifatiche. Nella malattia renale cronica, dialisi e trapianto (terza edizione). Recuperato da ScienceDirect.com.
- Li, h. et al. (2019). Influenza delle condizioni atmosferiche sull'acido solforico-dimetilammina-ammonia basata sulla formazione di nuove particelle. CHOSPER 2019; 245: 125554. NCBI recuperato.Nlm.NIH.Gov.
- Mackie, J.C. e Kennedy, e.M. (2019). Pirolisi di glifosato e canzoni Tossici. Ambiente. Sci. Technol. 2019: 53 (23): 13742-13747. NCBI recuperato.Nlm.NIH.Gov.

