Quali sono le leggi sul peso della chimica? (Esempi)

- 3351
- 1026
- Lino Lombardi
IL Leggi indossate della chimica Sono quelli che hanno dimostrato che le masse delle sostanze che reagiscono non lo fanno arbitrariamente o in modo casuale; ma mantenendo una proporzione matematica costante di numeri interi o sottomulti di essi, in cui gli atomi degli elementi non sono creati o distrutti.
In passato, stabilire queste leggi richiedeva straordinari sforzi di ragionamento; Perché sebbene ora sembra troppo evidente, prima che le masse atomiche o molecolari degli elementi o dei composti non fossero nemmeno noti, rispettivamente.
 Fonte: Jeff Keyzer di Austin, TX, USA [CC BY-SA 2.0 (https: // creativeCommons.Org/licenze/by-sa/2.0)]
Fonte: Jeff Keyzer di Austin, TX, USA [CC BY-SA 2.0 (https: // creativeCommons.Org/licenze/by-sa/2.0)] Dal momento che non si sapeva che esattamente un mole di atomi di ciascun elemento fosse equivalente, le sostanze chimiche del diciottesimo e diciannovesimo secolo dovevano essere basate sulle masse reagenti. In modo che le scale analitiche rudimentali (immagine superiore) fossero inseparabili compagni durante le centinaia di esperimenti necessari per l'insediamento delle leggi di ponderazione.
È per questo motivo che quando queste leggi della chimica sono studiate, si sono imbattute in misurazioni di massa in ogni momento. Grazie a ciò, estrapolando i risultati degli esperimenti, è stato scoperto che i composti chimici Puro Si formano sempre con la stessa percentuale di massa dei loro elementi costituenti.
[TOC]
Legge della conservazione della massa
Questa legge afferma che in una reazione chimica, la massa totale dei reagenti è pari alla massa totale dei prodotti; Finché il sistema considerato è chiuso e non vi è alcun cambio di massa ed energia con l'ambiente circostante.
In una reazione chimica, le sostanze non scompaiono, ma si trasformano in altre sostanze di massa uguale; Da lì la famosa frase: "Nulla è creato, nulla viene distrutto, tutto è trasformato".
Storicamente, la legge della conservazione di massa in una reazione chimica fu proposta per la prima volta nel 1756 da Mikhail Lomonsov, che mostrò nel suo diario i risultati dei suoi esperimenti.
Successivamente nel 1774, Antoine Levoisier, un chimico francese, presentò i risultati dei suoi esperimenti che consentivano di stabilirlo; che, alcuni lo chiamano anche la legge di Lavoisier.
-Esperimenti di Lavoisier
Al tempo di Lavoisier (1743-1794), c'era la teoria di Flogisto, secondo la quale i corpi avevano la capacità di infiammare o bruciare. Gli esperimenti di Lavoisier hanno permesso di scartare questa teoria.
Lavoisier ha eseguito numerosi esperimenti di combustione metallica. Ha pesato con cura i materiali prima e dopo la sua combustione in un contenitore chiuso, scoprendo che c'era un apparente aumento di peso.
Ma il Lavoiser, basato sulla conoscenza del ruolo dell'ossigeno nella combustione, ha concluso che l'aumento di peso nella combustione era dovuto all'incorporazione di ossigeno nel materiale di combustione. È nato il concetto di ossidi metallici.
Pertanto, la somma delle masse dei metalli sottoposti a combustione e ossigeno è rimasta inalterabile. Questa conclusione ha permesso l'istituzione della legge sulla conservazione di massa.
-Bilanciamento delle equazioni
La legge sulla conservazione di massa ha stabilito la necessità di bilanciare le equazioni chimiche, garantendo che il numero di tutti gli elementi coinvolti in una reazione chimica, nonché reagenti o prodotti, è esattamente lo stesso.
Questo è un requisito essenziale per l'accuratezza dei calcoli stechiometrici.
-Calcoli
Moli d'acqua
Quante moli d'acqua possono verificarsi durante la combustione di 5 moli di metano in un eccesso di ossigeno? Dimostra anche che la legge della conservazione della materia è soddisfatta.
Cap4 + 2 o2 => Co2 + 2 h2O
Osservando l'equazione equilibrata della reazione, si è concluso che 1 mol di metano produce 2 moli d'acqua.
Il problema può essere risolto direttamente con un approccio semplice, poiché non abbiamo 1 mol ma 5 moli di Cho4:
Moli d'acqua = 5 moli di Cho4· (2 moli di H2O / 1 mol di Cho4)
= 10
Cosa sarebbe equivalente a 180 g di H2O. Sono stati formati anche 5 mol o 220 g di CO2, che è pari a una massa totale di 400 g di prodotti.
Pertanto, per la legge della conservazione del soggetto a reagire 400 g di reagenti; Ne più ne meno. Di quei 400 g, 80 g corrispondano alle 5 moli di Cho4 (moltiplicando per la sua massa molecolare di 16 g/mol) e 320 g a 10 moli di O2 (Analogamente a causa della sua massa molecolare di 32 g/mol).
Combustione di un nastro di magnesio
Un nastro di magnesio da 1,50 g bruciato in un contenitore chiuso contenente 0,80 g di ossigeno. Dopo la combustione, 0,25 g di ossigeno erano nel contenitore. a) ciò che la massa di ossigeno ha reagito? b) quanto ossido di magnesio è stato formato?
Può servirti: soluzione ipotonica: componenti, preparazione, esempiLa massa di ossigeno che ha reagito è ottenuta da una semplice differenza.
Massa ossigeno consumata = (massa iniziale - massa residua) ossigeno
= 0,80 g - 0,25 g
= 0,55 g o2 (A)
Secondo la legge sulla conservazione di massa,
Massa di ossido di magnesio = massa di magnesio +massa di ossigeno
= 1,50 g + 0,55 g
= 2,05 g MGO (B)
Legge di proporzioni definite
Joseph Louis Proust (1754-1826), chimico francese, si rese conto che in una reazione chimica gli elementi chimici reagiscono sempre in proporzioni di massa fissa per formare un composto puro specifica; Pertanto, la sua composizione è costante, indipendentemente dalla fonte o dall'origine o da come viene sintetizzata.
Proust nel 1799 dichiarò la legge delle proporzioni definite, che afferma che: "Quando due o più elementi sono combinati per formare un composto, lo fanno in una relazione di massa fissa". Quindi, questa relazione è fissa e non dipende dalla strategia seguita per la preparazione del composto.
Questa legge è anche conosciuta come la legge della costante composizione, che afferma che: "ogni composto chimico in purezza contiene sempre gli stessi elementi, in una proporzione costante di massa".
-Illustrazione della legge
Iron (Faith) reagisce con lo zolfo per formare solfuro di ferro (FES), è possibile indicare tre situazioni (1, 2 e 3):
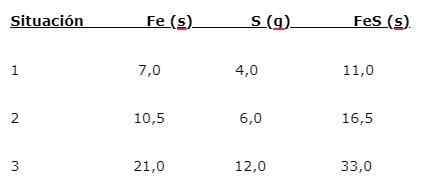
Per trovare la proporzione in cui gli elementi sono combinati, la massa principale (fede) è divisa per le massa minori. Il calcolo fornisce una percentuale di 1,75: 1. Questo valore viene ripetuto nelle tre condizioni fornite (1, 2 e 3), dove si ottiene la stessa proporzione sebbene vengano utilizzate masse diverse.
Vale a dire che 1,75 g di fede sono combinati con 1,0 g di s per dare 2,75 g di FES.
-Applicazioni
Attraverso l'applicazione questa legge, puoi sapere esattamente le masse degli elementi che devono essere combinati per ottenere una massa desiderata di un composto.
In questo modo, possono essere ottenute informazioni sulla massa rimanente di uno qualsiasi degli elementi coinvolti in una reazione chimica o se esiste un reagente limitante nella reazione.
Inoltre, si applica per conoscere la composizione centesimale di un composto e basata su quest'ultimo, la formula di un composto può essere stabilita.
Composizione centesimale di un composto
Anidride carbonica (CO2) si forma nella seguente reazione:
C +o2 => Co2
12 g di carbonio 32 g di ossigeno sono combinati per dare 44 g di anidride carbonica.
Quindi, la percentuale di carbonio è uguale a
Percentuale di carbonio = (12 g / 44 g) · 100 %
= 27,3 %
Percentuale di ossigeno = (32 g / 44 g) · 100 %
Percentuale di ossigeno = 72,7 %
Usando la dichiarazione della legge della composizione costante, si può notare che l'anidride carbonica è sempre formata dal 27,3 % di carbonio e 72,7 %.
-Calcoli
Triossido di zolfo
Reagendo in diversi contenitori 4 e 6 g di zolfo con ossigeno (O), sono stati ottenuti, rispettivamente, 10 g e 15 g di triossido di zolfo (SO3).
Perché tali quantità di triossido di zolfo e non altri?
Calcola anche la quantità di zolfo necessaria per combinare con 36 g di ossigeno e l'impasto di triossido di zolfo ottenuto.
Parte A)
Nel primo contenitore, 4 g g di ossigeno sono miscelati per ottenere 10 g di triossido. Se viene applicata la legge sulla conservazione della massa, possiamo cancellare la massa di ossigeno combinata con lo zolfo.
Massa di ossigeno = 10 g di triossido di ossigeno - 4 g di zolfo.
= 6 g
Nel contenitore 2 6 g di zolfo sono miscelati con x g di ossigeno per ottenere 15 triossido di zolfo.
Massa di ossigeno = 15 g di triossido di zolfo - 6 g di zolfo
= 9 g
Le proporzioni O/S per ciascun contenitore vengono quindi calcolate:
Proporzione o / s nella situazione 1 = 6 g o / 4 g s
= 1.5 / 1
Proporzione o / s nella situazione 2 = 9 g o / 6 g s
= 1.5 / 1
Che, concorda con ciò che viene sollevato nella legge delle proporzioni definite che indicano che gli elementi sono sempre combinati nella stessa proporzione per formare un determinato composto.
Pertanto, i valori ottenuti sono corretti e quelli che corrispondono all'applicazione della legge.
Parte B)
Nella sezione precedente è stato calcolato un valore di 1,5 / 1 per la proporzione O / S.
Può servirti: stati di aggregazione della materiag di zolfo = 36 ossigeno · (1 g di zolfo / 1,5 g di ossigeno)
= 24 g
g di triossido di zolfo = 36 g di ossigeno + 24 g di zolfo
= 60 g
Cloro e magnesio
Il cloro e il magnesio sono combinati nella proporzione di 2,95 g di cloro per ogni g di magnesio. a) Determinare le masse di cloro e magnesio necessarie per ottenere 25 g di cloruro di magnesio. b) Qual è la composizione percentuale del cloruro di magnesio?
Parte A)
Sulla base del valore 2.95 per il rapporto CL: Mg, è possibile apportare il seguente approccio:
2,95 g di Cl +1 g di mg => 3,95 g di MGCL2
Poi:
g di cl = 25 g di mgcl2 · (2,95 g CL / 3,95 g MGCL2)
= 18.67
G di mg = 25 g di mgcl2 · (1 g mg / 3,95 g MGCL2)
= 6.33
Quindi, 18,67 g di cloro sono combinati con 6,33 g di magnesio per produrre 25 g di cloruro di magnesio.
Parte B)
La massa molecolare del cloruro di magnesio, MGCL viene calcolata prima2:
Peso molecolare MGCL2 = 24,3 g/mol + (2 · 35,5 g/mol)
= 95,3 g/mol
Percentuale di magnesio = (24,3 g / 95,3 g) x 100 %
= 25,5 %
Percentuale di cloro = (71 g / 95,3 g) x 100 %
= 74,5 %
Legge di molteplici proporzioni o legge di Dalton
La legge fu dichiarata nel 1803 dal chimico e meteorologo francese John Dalton, sulla base delle sue osservazioni sulle reazioni dei gas atmosferici.
La legge è stata dichiarata come segue: "Quando gli elementi sono combinati per dare più di un composto, una massa variabile di uno di loro si unisce a una massa fissa dell'altra e la prima ha una relazione di canoni e numeri indistinti".
Inoltre: "Quando due elementi sono combinati per causare diversi composti, data una quantità fissa di uno di essi, le diverse quantità dell'altro elemento che sono combinate con quella quantità fissa per produrre i composti, sono in relazione a numeri interi semplici".
John Dalton ha fatto la prima descrizione moderna dell'atomo come componente degli elementi chimici, quando ha sottolineato che gli elementi sono formati da particelle indivisibili chiamate atomi.
Inoltre, ha ipotizzato che i composti si formino quando atomi di diversi elementi si combinano tra loro in proporzioni di numeri interi semplici.
Dalton ha completato i lavori di ricerca di Proust. Ha sottolineato l'esistenza di due ossidi di stagno, con percentuali dell'88,1% e del 78,7% di stagno con le corrispondenti percentuali di ossigeno, rispettivamente 11,9% e 21,3%.
-Calcoli
Perossido di acqua e idrogeno
Mostra che i composti idrici, h2O perossido di idrogeno, h2O2, Rispettano la legge di molteplici proporzioni.
Pesi atomici degli elementi: h = 1 g/mol e ossigeno = 16 g/mol.
Pesos molecolare dei composti: h2O = 18 g/mol e h2O2 = 34 g/mol.
L'idrogeno è l'elemento con una quantità fissa in H2O e h2O2, Quindi le proporzioni tra O e H saranno stabilite in entrambi i composti.
Rapporto O/H in H2O = (16 g/mol)/(2 g/mol)
= 8/1
Rapporto O/H in H2O2 = (32 g/mol)/(2 g/mol)
= 16/1
Relazione tra le due proporzioni = (16/1)/(8/1)
= 2
Quindi, il rapporto tra OR/H tra perossido di idrogeno e acqua è 2, un numero intero e un numero semplice. Vi è dimostrato conformità con la legge di più proporzioni.
Ossido d'azoto
Quale massa di ossigeno viene combinata con 3,0 g di azoto in a) ossido nitrico, no e b) diossido di azoto, no2. Mostra che no e no2 Rispettano la legge di molteplici proporzioni.
Massa di azoto = 3 g
Pesi atomici: azoto, 14 g/mol e ossigeno, 16 g/mol.
Calcoli
Nel NO, un atomo di N è combinato con 1 atomo di O, in modo che la massa di ossigeno combinata con 3 g di azoto possa essere calcolata con il seguente approccio:
G di O = G azoto · (PA. O / pa. N)
= 3 g · (16 g/mol/14 g/mol)
= 3,43 g o
Nel no2, Un atomo di N è combinato con 2 atomi di O, quindi la massa di ossigeno che viene combinata è:
g di ossigeno = 3 g · (32 g/mol/14 g/mol)
= 6,86 g o
Proporzione o/ n a no = 3,43 g o/ 3 g n
= 1,143
Proporzione o/n in no2 = 6,86 g o / 3 g n
= 2.282
Valore della relazione tra le proporzioni O / N = 2.282 / 1.143
= 2
Quindi, il valore della relazione tra le proporzioni o/n è 2, un numero intero e un numero semplice. Pertanto, la legge di molteplici proporzioni è soddisfatta.
Legge delle proporzioni reciproche
Questa legge formulata da Richter e Carl f. Wenzel separato.
Può servirti: sodio: storia, struttura, proprietà, rischi e usiAd esempio, se hai i due composti AB e CB, si osserva che l'elemento comune è B.
La legge di Richter-Wenzel o le proporzioni reciproche afferma che, sapere quanto reagisce a B per dare AB e quanto C reagisce con B per dare CB, è possibile calcolare la massa di cui è necessario reagire con una massa C per Forma Ac.
E il risultato è che la proporzione a: c o a/c deve essere un multiplo o sottomulpio di a/b o c/b. Tuttavia, questa legge non è sempre soddisfatta, specialmente quando gli elementi presentano diversi stati di ossidazione.
Di tutte le leggi sul peso questo è forse il più "astratto" o complicato. Ma se analizzato da un punto di vista matematico, si vedrà che consiste solo in fattori di conversione e cancellazione.
-Esempi
Metano
Se è noto che 12 g di carbonio reagiscono con 32 g di ossigeno per formare l'anidride carbonica; e che, d'altra parte, 2 g di idrogeno reagiscono con 16 g di ossigeno per formare acqua, quindi possono essere stimate le proporzioni di massa c/o e h/o per la CO2 e h2O, rispettivamente.
Calcolo di c/o e h/o hai:
C / o = 12 g c / 32g o
= 3/8
H / O = 2G H / 16G o
= 1/8
L'ossigeno è l'elemento comune ed è desiderato sapere quanta carbonio reagisce con l'idrogeno per produrre metano; Cioè, vuoi calcolare C/H (o H/C). Quindi, è necessario fare una divisione delle proporzioni precedenti per dimostrare se la reciprocità è o meno soddisfatta:
C/H = (C/O)/(H/O)
Si noti che in questo modo il sistema operativo viene cancellato e C/H rimane:
C/H = (3/8)/(1/8)
= 3
E 3 è un multiplo 3/8 (3/8 x 8). Ciò significa che 3 g di C reagisce con 1 g di h per dare metano. Ma, per poterlo confrontare con il CO2, È moltiplicato C/H per 4, che è uguale a 12; Questo dà 12 g di C che reagisce con 4 g di h per formare metano, il che è anche vero.
Solfuro di magnesio
Se è noto che 24 g di magnesio reagiscono con 2 g di idrogeno per formare idruro di magnesio; E inoltre, 32 g di zolfo reagiscono con 2 g di idrogeno per formare idrogeno solforato, l'elemento in comune è idrogeno e vuole calcolare Mg/s da mg/h e h/s.
Quindi calcolando mg/h e h/s separatamente hai:
Mg / h = 24 g mg / 2g H
= 12
H / S = 2G H / 32G S
= 1/16
Tuttavia, è conveniente utilizzare S/H per annullare H. Pertanto, S/H è uguale a 16. Fatto questo, procediamo a calcolare mg/s:
Mg/s = (mg/h)/(s/h)
= (12/16)
= 3/4
E 3/4 è un sottomulpio di 12 (3/4 x 16). La proporzione mg/s indica che 3 g di mg reagisce con 4 g di zolfo per formare solfuro di magnesio. Tuttavia, devi moltiplicare Mg/s per 8 per poterlo confrontare con Mg/H. Pertanto, 24 g di mg reagisce con 32 g di zolfo per dare questo solfuro metallico.
Cloruro di alluminio
È noto che 35,5 g di Cl reagiscono con 1 g di h per formare HCl. Inoltre, 27 g di Al reagisce con 3 g di h per formare Alh3. Calcola la proporzione di cloruro di alluminio e dire se tale composto obbedisce alla legge di Richter-Wenzel.
Ancora una volta, CL/H e AT/H sono calcolati separatamente:
CL / H = 35,5 g CL / 1G H
= 35.5
AT/ H = 27G AT/ 3G H
= 9
Ora è calcolato a/cl:
AT/Cl = (Al/H)/(Cl/H)
= 9/35.5
≈ 0,250 o 1/4 (è in realtà 0,253)
Cioè, 0,250 g di Al reagisce con 1 g di Cl per formare il sale corrispondente. Ma, ancora una volta, deve essere moltiplicato a/Cl per un numero che consente di confrontarlo (per il comfort) con Al/H.
Impreciazioni nel calcolo
Viene quindi moltiplicato a/cl per 108 (0,27/250), dando 27 g di cui reagisce con 108 g di Cl. Questo non accade esattamente. Se prendiamo ad esempio il valore 0,253 di AL/CL e lo moltiplichiamo per 106,7 (27/0,253), 27 g di AL reagisce con 106,7 g di Cl; Che, si avvicina di più alla realtà (Alcl3, con un PA di 35,5 g/mol per il CL).
Qui si osserva come la legge di Richter possa iniziare a staggy a causa della precisione e dell'uso improprio dei decimali.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Fiori, j. Chimica (2002). Editoriale di Santillana.
- Joaquín San Frutos Fernández. (S.F.). Il peso e le leggi volumetriche. Recuperato da: encce.pntic.Mec.È
- Toppr. (S.F.). Leggi della combinazione chimica. Recuperato da: toppr.com
- Brillante. (2019). Leggi della combinazione chimica. Recuperato da: brillante.org
- Chimica librettexts. (15 luglio 2015). Leggi chimiche fondamentali. Recuperato da: Chem.Librettexts.org
- Helmestine, Anne Marie, PH.D. (18 gennaio 2019). Legge della conservazione della massa. Recuperato da: Thoughtco.com
- « Discoveria della Conquista della Colombia, fasi, conseguenze
- 9 risultati di lavoro della carriera di amministrazione aziendale »

