Qual è l'elemento più elettronegativo e perché?

- 3064
- 827
- Lino Lombardi
 L'elemento più elettronegativo è il fluoruro (F), bloccato nel cerchio rosso
L'elemento più elettronegativo è il fluoruro (F), bloccato nel cerchio rosso Lui Elemento più elettronegativo Nella tabella periodica è il fluoro, la cui sostanza chimica è f e appartiene al gruppo alogeno. Tra tutti gli elementi della tavola periodica, il fluoro è il più ansioso di catturare elettroni da altri atomi.
Questo elemento, gassoso a temperatura ambiente, è altamente reattivo e quindi non è facile trovarlo in uno stato puro in natura. Il fluoro si collega facilmente con altri elementi come zolfo, calcio e metalli, nonché numerosi composti, in particolare quelli contenenti idrogeno.
La sua elevata elettronegatività ti consente di combinarti con gas nobili come Xenon, Kripton e Radon.
Dopo il fluoro, l'ossigeno è il secondo elemento con la massima elettronegatività. Al contrario, gli elementi con l'elettronegatività più bassa sono Francesco (FR) e Cesio (CS).
 Poiché è l'elemento più elettronegativo, il fluoro forma numerosi composti, come fluorite o fluoruro di calcio. Fonte: Wikimedia Commons
Poiché è l'elemento più elettronegativo, il fluoro forma numerosi composti, come fluorite o fluoruro di calcio. Fonte: Wikimedia Commons Questi sono, quindi, di più elettropositivo esiste, sebbene Francesco sia radioattivo e molto poco in natura.
Elettronegatività e tavola periodica
La portata dell'elettronegatività è stata sviluppata dal chimico e dal premio Nobel Linus Pauling (1901-1994), sebbene il concetto sia dovuto al chimico svedese Jöns Jakob Berzelius (1779-1848).
La scala Pauling, che assegna valori numerici dimensionali all'elettronegatività, viene utilizzata per misurare l'intensità con cui un atomo attira l'elettrone di un altro atomo diverso, e quindi i collegamenti della forma.
Ogni elemento ha la sua elettronegatività, che dipende dalle sue proprietà atomiche. È determinato sperimentalmente e indirettamente, ad esempio, misurando l'energia del collegamento, come ha fatto Pauling intorno al 1932.
Sulla scala di elettronegatività Pauling, il fluoro è il primo, con un valore approssimativo di 3.98 ≈ 4.0.
Può servirti: idrocarburi alifatici: proprietà, nomenclatura, reazioni, tipiL'elettronegatività è una proprietà periodica degli elementi. Nella maggior parte dei casi (ci sono alcune eccezioni), si osserva che l'elettronegatività aumenta quando si sposta da sinistra a destra attraverso i ranghi della tabella periodica.
E anche, aumenta dal basso verso l'alto, spostandosi su una colonna.
 La tavola periodica di elettronegatività secondo la scala Pauling. Il fluoro è l'elemento più elettronegativo, situato sopra e sulla destra, mentre Francesco è il meno elettronegativo di tutti, o il più elettropositivo, se preferito, ed è nella colonna sinistra e giù. Fonte: f. Zapata.
La tavola periodica di elettronegatività secondo la scala Pauling. Il fluoro è l'elemento più elettronegativo, situato sopra e sulla destra, mentre Francesco è il meno elettronegativo di tutti, o il più elettropositivo, se preferito, ed è nella colonna sinistra e giù. Fonte: f. Zapata. Elettronegatività al fluoro
Il motivo per cui il fluoro è l'elemento più elettronegativo nella tabella periodica, è dovuto alla sua configurazione elettronica (il modo in cui i suoi elettroni sono disposti in orbitali attorno al nucleo).
Questa configurazione è 1s22s22 p5, Quindi il fluoro ha 5 elettroni nel suo strato più esterno.
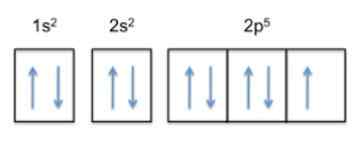
Ora, poiché la tendenza dell'atomo è quella di completare il suo strato esterno, ciò significa che il fluoro accetterà un elettrone di altri atomi con grande facilità, al fine di guadagnare stabilità e assomigliare al gas nobile della stessa fila, che è il neon , la cui configurazione elettronica è 1s22s22 p6.
L'atomo di fluoro ha un raggio molto piccolo, poiché i protoni nel loro nucleo attirano fortemente elettroni, mantenendoli più vicini che negli atomi di elementi meno elettronegativi, come Cessium e Francia.
Pertanto, questi ultimi sono disposti a rinunciare facilmente agli elettroni per formare collegamenti.
Riferimenti
- Aguilar, c. Guida per l'unità di apprendimento chimico I. Estratto da: IPN.MX.
- Atkins, p. (2005). Principi di chimica, i percorsi della scoperta. 3 °. Edizione. Pan -American Medical Editoriale.
- Clark, J. Elettronegività. Recuperato da: Chem.Librettexts.org.
- Hein, m. (2014). Fondazioni di chimica del college. 14 ° ed. Wiley.
- Lentech. Elementi chimici ordinati dalla sua elettronegatività. Recuperato da: lentech.È.

