Legame chimico
- 4355
- 170
- Enzo De Angelis
Spieghiamo quali sono i collegamenti chimici, i tipi che esistono e diamo molti esempi
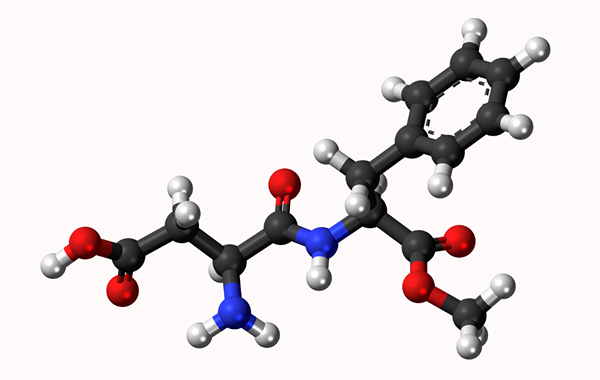
 Modello molecolare ASPARTAMO: collegamento semplice rappresentato da una linea e doppio legame per due righe. Le palle sono atomi
Modello molecolare ASPARTAMO: collegamento semplice rappresentato da una linea e doppio legame per due righe. Le palle sono atomi Cos'è un legame chimico?
UN Legame chimico È la forza che tiene insieme gli atomi di un composto. La forza che unisce gli atomi è elettromagnetica e quando gli atomi sono legati mantengono la propria natura.
Ad esempio, l'acqua comune si forma a causa dell'unione di due atomi di idrogeno (H2) e uno di ossigeno (O); Ecco perché la sua formula chimica è h2O. Sebbene siano uniti per formare acqua, gli atomi di idrogeno rimangono idrogeno e l'ossigeno è ancora ossigeno.
Ricordiamo che gli atomi sono formati da un nucleo circondato da una nuvola di elettroni, che hanno un carico negativo. Il nucleo dell'atomo ha una carica positiva, che riesce ad attrarre elettroni.
Tuttavia, gli elettroni sono anche attratti dai nuclei di altri atomi. Ecco come si formano i collegamenti chimici. Il fatto che gli atomi producono o condividono elettroni generano i diversi tipi di collegamenti chimici.
In legami chimici, gli atomi producono, vincono o condividono elettroni di quello che viene chiamato strato di Valencia, che è lo strato più esterno di un atomo in cui si verifica la reattività o la tendenza a formare legami chimici.
Questi collegamenti creano nuove sostanze (non miscele) che non possono essere separate attraverso tecniche come setaccio o filtraggio.
Tipi di legame chimico
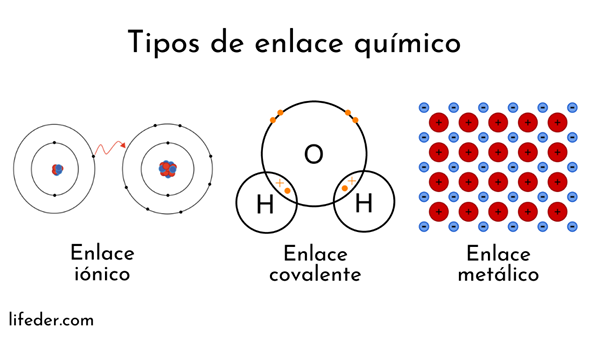
Gli atomi sono formati da un nucleo (con carica elettrica positiva) ed elettroni (particelle con carica elettrica negativa) che ruotano intorno. Entrambe le parti intervengono in legami chimici.
I legami chimici che coinvolgono i nuclei atomici sono chiamati metallici. D'altra parte, quelli che coinvolgono lo scambio di elettroni sono divisi in ioni e covalenti.
Può servirti: clorobenzene (C6H5Cl)Collegamenti ionici
Questo tipo di collegamento è molto resistente; produce composti chimici solidi (cristalli) nell'acqua e con un punto di fusione elevato (tra 300 e 1.000 gradi Celsius). Sciolto in acqua, sono conduttori di elettricità.
Come sono i collegamenti ionici?

I legami ionici si verificano tra un metallo e un non metal che ha elettronegatività diversa (capacità di attrarre elettroni). Gli elettroni dello strato di Valencia di un atomo passano all'altro atomo di Valencia. Che è lo stesso; Un atomo metallico dà un elettrone a un atomo non metallico, raggiungendo la stabilità elettronica.
Durante tutto il processo di formazione del collegamento sono formati gli ioni (cationi e anioni), da cui il nome del legame ionico.
Un esempio di questo tipo di legame è il cloruro di sodio: questo composto chimico si forma quando il cloro (CL) attira l'elettrone dello strato di valenza che ha l'atomo di sodio (NA).
Un altro esempio è il cloruro di manganese (MGC), che viene utilizzato nella produzione di dipinti e disinfettanti. Come risultato del legame chimico, gli elettroni dell'atomo di manganese vengono assorbiti dall'atomo di cloro.
Collegamenti covalenti
I legami covalenti sono molto duri e generano composti chimici insolubili con una temperatura di fusione elevata (più di 1.000 gradi Celsius). Non conducono elettricità.
Secondo il modo in cui gli atomi condividono i loro elettroni, i legami covalenti possono essere:
- Semplice: Condividono un paio di elettroni (A-A).
- Doppio: Condividi due coppie di elettroni (a =).
- Triplicare: Condividi tre coppie di elettroni (A solito).
Come si formano i legami covalenti?

Il legame covalente si forma quando due elementi non metallici condividono gli elettroni del loro strato di valenza.
Può servirti: Rubido: storia, proprietà, struttura, ottenimento, usiLo scambio di elettroni si verifica sempre in modo tale da rispettare la legge dell'ottetto. Questo è un principio chimico che afferma che la configurazione più stabile per un atomo è quella in cui ha otto elettroni nel suo strato più esterno.
Un esempio di legame covalente è l'acqua (h2O). Per creare la molecola d'acqua, sono necessari due semplici legami covalenti. In un semplice legame l'elettrone idrogeno è condiviso con ossigeno e l'ossigeno condivide un elettrone con idrogeno.
Un altro esempio di legame covalente è l'anidride carbonica (CO2), uno dei principali responsabili dell'effetto serra e dei cambiamenti climatici. Per formare questo composto, il carbonio e l'ossigeno creano due doppi legami, ovvero per ogni collegamento due coppie di elettroni condividono.
Collegamenti metallici
Questo tipo di collegamento avviene solo negli elementi metallici. È costituito dall'unione dei nuclei di due atomi dello stesso elemento metallico insieme ai loro elettroni.
I collegamenti metallici sono caratterizzati da conduttori di elettricità efficaci, con una fusione e un punto di ebollizione molto elevato e facilmente ossidati. Sono anche malleabili e resistenti a graffi, molto solidi e forti.
Come sono i collegamenti in metallo?
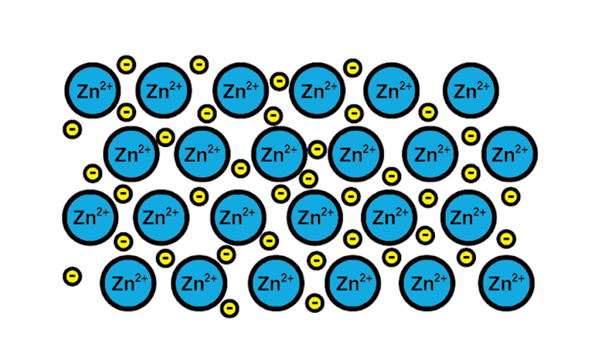 Link metallico di zinco
Link metallico di zinco Un esempio di collegamento metallico è quello dello zinco, un elemento metallico. Il processo di formazione di questo tipo di collegamento è:
1-A Nucleo atomico di un elemento metallico incontra un altro nucleo dello stesso elemento.
2-Gli elettroni dello strato di Valencia di entrambi i nuclei diventano un mare di elettroni intorno. Cioè, non orbitano un singolo nucleo atomico.
3-I carichi positivi dei nuclei atomici e i negativi degli elettroni sono attratti. Il risultato sono gli elettroni di valenza che formano il mare di elettroni attorno ai nuclei atomici (cationi).
Può servirti: solfato di rame (CUSO4): struttura, proprietà, ottenimento, usiEsempi di legami chimici
Collegamenti ionici
- Bario ossido (Bao).
- Cloruro di magnesio (MGCL2).
- Ossido di calcio (CAO)
- Nitrato d'argento (agno3)
- Idrossido di zinco (Znoh2)
- Bromuro di potassio (KBR)
- Carbonato di calcio (Caco3)
- Rame solfato (CUO4)
- Fluoruro di litio (LIF)
- Cloruro di manganese (MNCL2)
- Solfato di potassio (K2SW4)
- Ossido di ferro (brutto)
- Fosfato disodico (NA2HPO4)
- Potassio ioduro (ki)
Collegamenti covalenti
- Anidride carbonica (CO2)
- Ammoniaca (NH3)
- Paraffina (CNH2N+2)
- Diesel (c12H26)
- Dibromo (Br2)
- Monossido di carbonio (CO)
- Butano (c4H10)
- Benzene (c6H6)
- Azoto molecolare (n2)
- Metano (ch4)
- Acido cloridrico (HCL)
- Acido cianidrico (HCN)
Collegamenti metallici
Qualsiasi metallo nel suo stato puro è un esempio di collegamento metallico, vale a dire:
- Nichel (NI)
- Iron (Faith)
- Alluminio (AL)
- Titanio (TI)
- Lead (PB)
- Cobalt (CO)
- Rame (Cu)
- Zinco (Zn)
- Mercurio (HG)
- Oro (AU)
- Argento (AG)
- Bario (BA)
Importanza dei legami chimici
L'importanza dei legami chimici è che formano molecole organiche e inorganiche, e in questo modo fanno parte della base di tutti gli organismi viventi. Se sono sottoposti a determinate condizioni, questi collegamenti possono essere rotti. Questa energia è chiamata Collegamento energetico.
Alcune delle tecniche per rompere i collegamenti sono applicate per elettricità, alte temperature o provocando reazioni chimiche con composti diversi.
Ad esempio, per separare le molecole di ossigeno e idrogeno da H2Oppure, possiamo applicare l'elettricità all'acqua, che è il processo noto come elettrolisi.
I composti chimici formati da collegamento sono numerosi e sono presenti nella vita di tutti i giorni. Il sale che usiamo per la stagione è un prodotto composto chimico del legame tra un atomo di sodio (NA) e un cloro (CL) (CL). La sua formula chimica è NaCl, che legge il cloruro di sodio.

