Costante di velocità

- 5106
- 1646
- Benedetta Rinaldi
Qual è la costante di velocità?
IL costante di velocità È una costante di proporzionalità della legge di velocità della cinetica chimica, che stabilisce una relazione tra la concentrazione molare dei reagenti e la velocità della reazione.
Man mano che i reagenti, le velocità di reazione consumano, diminuiscono anche. Ecco perché nei calcoli della costante di velocità, rappresentati dal simbolo "k", le velocità iniziali sono prese in considerazione, per avere un punto di confronto tra diversi esperimenti.

La cinetica chimica indica che questa costante dipende dagli ordini di reazione dei reagenti, le cui concentrazioni alterano la velocità della reazione. D'altra parte, secondo l'equazione di Arrhenius, K dipende anche dalla temperatura e dall'energia di attivazione per la reazione.
Ecco perché si dice che la costante di velocità non sia una vera costante, poiché varia con la temperatura e anche con la presenza di catalizzatori che modificano l'energia di attivazione. Pertanto, non ci sono molte tabelle in cui arrivano per reazioni (e condizioni) specifiche.
Ad esempio, per una reazione in cui A e B reagiscono, ciascuno con un ordine di reazione di 1, la costante ha riportato da K a 25 ° C e con l'aggiunta di una certa quantità di catalizzatore, non sarà la stessa se la reazione è fatto a una temperatura di 26 o 27 ºC. La minima variazione influenzerà il valore di K, che è costante solo durante le condizioni stabilite per gli esperimenti.
Come calcolare la costante di velocità?
Sperimentazione
La determinazione del valore della costante di velocità di una reazione viene effettuata sperimentalmente. Se, ad esempio, si desidera determinare il valore della costante di velocità per una reazione della forma:
A +B → C
Per l'istituzione del valore di K, è possibile effettuare tre reazioni, con le seguenti differenze: Nella reazione 2 la concentrazione iniziale del reagente A è costante, [a], ma è raddoppiata, ad esempio, la concentrazione del reagente B, [ B].
Nel frattempo, nella reazione 3 [A] viene raddoppiato rispetto alla reazione 1, mantenendo costante [B].
Pertanto, verrà costruita una tabella di concentrazioni che servirà a confrontare le velocità iniziali tra diversi esperimenti. Questo con lo scopo di determinare gli ordini di reazione e consecutivamente per calcolare la costante di velocità.
Può servirti: idrossido di alluminio: struttura, proprietà, usi, rischiOrdini di reazione
Primo calcolo
Per la reazione precedente la sua velocità è espressa dall'equazione:
Velocità di reazione = k · [a]X· [B]E
Dove 'x' e 'e' corrispondono rispettivamente agli ordini di reazione per i reagenti a e b.
Per determinare i valori degli ordini di reazione, è necessario effettuare un confronto tra la reazione 2 e 1, nonché tra la reazione 3 e 1.
Quando si confronta la reazione 1 con il 2, si potrebbe osservare, ad esempio, che duplicando [b] c'è una duplicazione della velocità di reazione.
Quindi: la proporzione di [b] tra le reazioni 2 e 1 è 2, nonché la proporzione tra le velocità delle reazioni. Quindi, il valore dell'ordine della reazione può essere ottenuto rispetto a B (esponente e), attraverso il seguente approccio:
 Calcolo dell'ordine di reazione "e". Fonte: Gabriel Bolívar.
Calcolo dell'ordine di reazione "e". Fonte: Gabriel Bolívar. La velocità dell'esperimento 2 è due volte più veloce della velocità dell'esperimento 1. Pertanto, dividendo le due equazioni sopra avremo:
2 = 2E
Pertanto, "e" Vale 1, essere in grado di concludere che l'ordine della reazione rispetto al reagente B è del primo ordine.
Secondo calcolo
Allo stesso modo procediamo con il reagente A per il calcolo di "X":
 Calcolo dell'ordine di reazione 'x'. Fonte: Gabriel Bolívar.
Calcolo dell'ordine di reazione 'x'. Fonte: Gabriel Bolívar. La velocità dell'esperimento o della reazione 3 è quattro volte superiore all'esperimento o alla reazione 1. Perciò:
4 = 2X
O
22 = 2X
E il valore di x è 2, quindi la reazione è il secondo ordine in relazione al reagente a.
Lancellatura finale
Quindi, è possibile stabilire il valore della costante di velocità in base a una qualsiasi delle reazioni:
Velocità di reazione = k · [a]2· [B]
Abbastanza per introdurre valori sperimentali e chiaro k:
K = velocità di reazione / ([a]2· [B])
Esempi
I seguenti esempi servono come introduzione prima che gli esercizi si risolvessero dalla sezione seguente.
Esempio 1
In una reazione chimica:
a) Se la concentrazione iniziale di un reagente viene raddoppiata la velocità della reazione: qual è l'ordine della reazione rispetto a questo reagente?
b) Se l'aumento della concentrazione del reagente provoca un aumento della velocità in un fattore 8, quale sarebbe l'ordine di reazione allora?
c) Se la concentrazione del reagente sperimenta un cambiamento e la velocità rimane la stessa: qual è l'ordine della reazione rispetto al reagente?
Può servirti: cycopropane (C3H6)In a) la proporzione delle velocità di reazione è la stessa e la proporzione delle concentrazioni di reagenti è uguale a 2X,
2 = 2X
Pertanto, x = 1 e l'ordine della reazione rispetto al reagente è 1.
In b) la proporzione della velocità di reazione è la stessa 8 (23) e la proporzione delle concentrazioni di reagenti è uguale a 2X,
23 = 2X
Pertanto, x = 3 e l'ordine della reazione rispetto al reagente è 3-
Mentre in c) la velocità della reazione è indipendente dalla concentrazione del reagente, quindi l'ordine della reazione rispetto al reagente è zero.
Esempio 2
La reazione:
2 n2 + O2 → 2 n2
Ha l'espressione della seguente legge sulla velocità:
Velocità di reazione = k · [no2"2·O2.
Qual è l'ordine globale della reazione? Quali unità avrebbero K?
L'ordine della reazione riguardante o2 È 1 e l'ordine della reazione rispetto a no2 È 2, quindi l'ordine globale della reazione è la somma di questi valori, cioè 2 + 1 = 3.
La velocità della reazione ha unità m/s e le concentrazioni dei reagenti sono espresse in m. Fare un'analisi delle unità che avremo:
k = velocità di reazione / ([no2"2·[O2"
= (M / s) / (m3)
= s-1M-2
Esercizi risolti
Esercizio 1
I dati della seguente reazione sono stati ottenuti a 25 ° C:
A +2 B → C +2 D
Qual è l'espressione della legge di velocità di questa reazione? Qual è il valore della tua costante di velocità?
Calcoli degli ordini di reazione
I dati sperimentali sono:
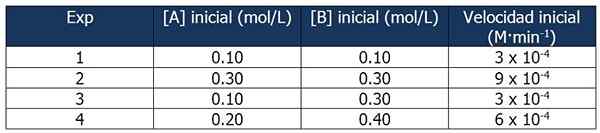 Dati cinetici dell'esercizio 1. Fonte: Gabriel Bolívar.
Dati cinetici dell'esercizio 1. Fonte: Gabriel Bolívar. Il confronto tra gli esperimenti 1 e 3 consente di trarre le seguenti conclusioni:
Proporzione tra le velocità delle reazioni 3 e 1:
3 x 10-4 M · min-1 / 3 x 10-4 M · min-1 = 1
Ma la proporzione tra le concentrazioni di B è:
(0.3 mol / l) / (0.1 mol/l) = 3
La velocità della reazione è indipendente dalla concentrazione di B, poiché il suo aumento non la influenza. Pertanto, l'ordine della reazione rispetto al reagente B è zero.
D'altra parte, il confronto delle reazioni 4 e 1 consente le seguenti conclusioni:
6 x 10-4 M · min-1 / 3 x 10-4 M · min-1 = 2
Nel frattempo, la proporzione tra [A] delle reazioni 4 e 1 è uguale a:
Può servirti: 5 caratteristiche delle miscele omogenee(0.20 mol / L) / (0.10 mol/l) = 2X
Quindi la relazione tra le proporzioni sarà:
2 = 2X
x = 1
Pertanto, l'espressione della legge di velocità è:
Velocità di reazione = k · [a]
B non è assunto perché il suo ordine della reazione è zero.
Calcolo di k
Possiamo calcolare la costante di velocità da uno qualsiasi dei dati cinetici. Usiamo l'esperimento 1:
K = velocità di reazione / [a]
= 3 x 10-4 M · min-1 / 0.10 m
= 3 x 10-3 o 0.003 min-1
Esercizio 2
I dati sulla velocità di reazione sono stati ottenuti a una certa temperatura.
2 clo2 (AC) +2 Oh- (AC) → CLO3- (AC) +CLO2 (AC) +H2O (l)
Calcoli degli ordini di reazione
I dati sperimentali sono:
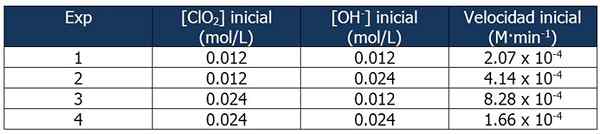 Dati cinetici sull'esercizio 2. Fonte: Gabriel Bolívar.
Dati cinetici sull'esercizio 2. Fonte: Gabriel Bolívar. La proporzione tra le velocità della reazione 2 e la reazione 1 è:
4.14 x 10-4 M · min-1 / 2.07 x 10-4 M · min-1 = 2
E la proporzione di concentrazioni di OH- Tra reazioni 2 e 1 è uguale a:
(0,024 mol/L)/(0,012 mol/L) = 2X
L'esponente 'x' rappresenta l'ordine della reazione rispetto al reagente OH-. La relazione tra proporzioni calcolate può essere rappresentata come segue:
2 = 2X
x = 1
Pertanto, l'ordine della reazione rispetto al reagente OH- è uguale a 1.
Nella reazione 3 la concentrazione di CLO è raddoppiata2 di reazione 1, mentre la concentrazione di OH- Rimane costante.
Proporzione tra le velocità delle reazioni 3 e 1:
(8.28 x 10-4 M · min-1) / (2.07 x 10-4 M · min-1) = 4 (22)
E la proporzione di [CLO2] tra le reazioni 3 e 1 è uguale a:
(0,024 mol/L)/(0,012 mol/L) = 2E
L'esponente "e" rappresentano l'ordine della reazione relativa al reagente CLO2.
Confrontando le proporzioni:
22 = 2E
4 = 2E
y = 2
Pertanto, la reazione è seconda rispetto al reagente CLO2.
L'espressione della legge di velocità sarà quindi:
Velocità di reazione = k · [clo2"2· [OH-"
Calcolo di k
Ancora una volta, possiamo calcolare K dall'espressione precedente usando uno qualsiasi dei dati cinetici per gli esperimenti. Useremo l'esperimento 3:
K = (8.28 x 10-4 M · min-1) / (0.024 m)2 (0.012 m)
= 119.79 min-1· M-2
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Wikipedia. (2020). Costante della velocità di reazione. Recuperato da: in.Wikipedia.org
- Chimica Texas A&M University. (S.F.). Cinetica: calcoli della frequenza del campione. Recuperato da: Chem.Tamu.Edu
- Keith J. Laidler. (2020). Velocità di reazione. Britannica Enciclopedia. Recuperato da: Britannica.com
- Helmestine, Anne Marie, PH.D. (25 agosto 2020). Qual è il tasso costante in chimica? Recuperato da: Thoughtco.com
- Clark Jim. (2013). Valuta le costanti e l'equazione di Arrhenius. Recuperato da: ChemGuide.co.UK

