Configurazione elettronica esterna
- 5020
- 534
- Rufo Longo
 Orbitali elettronici. Fonte: Patricia.FIDI, Wikimedia Commons
Orbitali elettronici. Fonte: Patricia.FIDI, Wikimedia Commons Cos'è la configurazione elettronica esterna?
IL Configurazione elettronica esterna, Chiamata struttura elettronica, è la disposizione degli elettroni a livelli e sotto -livelli di energia attorno a un nucleo atomico. I livelli sono da 1 a 7 e i sotto -livelli sono S, P, D e F.
Secondo il vecchio modello atomico di Bohr, gli elettroni occupano diversi livelli in orbite attorno al nucleo, del primo strato più vicino al nucleo, K, al settimo strato, Q, il più lontano.
In termini di un modello meccanico quantistico più raffinato, gli strati K-Q sono suddivisi in un insieme di orbitali, ognuno dei quali può essere occupato da non più di un paio di elettroni.
Comunemente, la configurazione elettronica viene utilizzata per descrivere gli orbitali di un atomo nel suo stato fondamentale, ma può anche essere usato per rappresentare un atomo che è stato ionizzato in un catione o anione, compensando la perdita o il guadagno degli elettroni nei rispettivi orbitali.
Molte delle proprietà fisiche e chimiche degli elementi possono essere correlate alle loro configurazioni elettroniche uniche. Gli elettroni di Valencia, gli elettroni nello strato più esterno, sono il fattore determinante per la chimica unica dell'elemento.
Concetti di base di configurazioni elettroniche
Prima di assegnare gli elettroni di un atomo agli orbitali, si deve acquisire familiarità con i concetti di base delle configurazioni elettroniche. Ogni elemento della tabella periodica è costituito da atomi, che sono composti da protoni, neutroni ed elettroni.
Gli elettroni mostrano un carico negativo e si trovano attorno al nucleo dell'atomo negli orbitali di elettroni, definiti come il volume dello spazio in cui l'elettrone può essere trovato entro il 95% di probabilità.
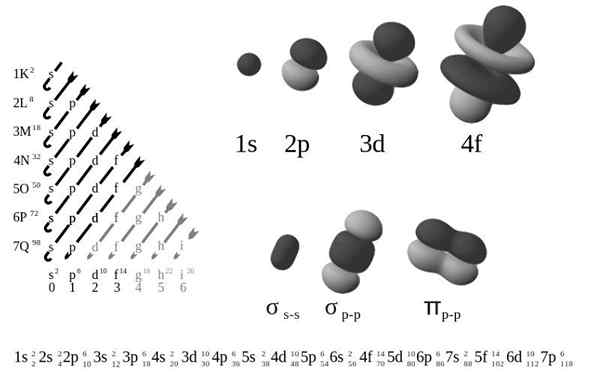
I quattro diversi tipi di orbitali (s, p, d e f) hanno modi diversi e un orbitale può contenere un massimo di due elettroni. Gli orbitali p, d e f hanno diversi livelli, in modo che possano contenere più elettroni.
Può servirti: reattore batch: caratteristiche, parti, applicazioniCome indicato, la configurazione elettronica di ciascun elemento è unica per la sua posizione nella tabella periodica. Il livello di energia è determinato dal periodo e il numero di elettroni è dato dal numero atomico dell'elemento.
Gli orbitali a diversi livelli di energia sono simili tra loro, ma occupano aree diverse nello spazio.
L'orbitale 1S e gli orbitali 2 hanno le caratteristiche di una S orbitale (nodi radio, probabilità del volume sferico, possono contenere solo due elettroni, ecc.). Ma, come lo sono a diversi livelli di energia, occupano spazi diversi intorno al nucleo. Ogni orbitale può essere rappresentato da blocchi specifici nella tabella periodica.
Il blocco S è la regione dei metalli alcalini, inclusi l'elio (gruppi 1 e 2), il blocco D sono metalli di transizione (gruppi da 3 a 12), il blocco P sono gli elementi del gruppo principale di gruppi 13 A 18 e il blocco F sono La serie di Lantanides e Actinids.
Principio di Aufbau
Aufbau viene dalla parola tedesca Aufbauen, Cosa significa "costruzione". In sostanza, quando scriviamo configurazioni di elettroni, stiamo costruendo orbitali di elettroni mentre avanziamo da un atomo a un altro.
Mentre scriviamo la configurazione elettronica di un atomo, riempiremo gli orbitali in ordine crescente di numero atomico.
Il principio di Aufbau proviene dal principio di esclusione di Pauli, che dice che non ci sono due fermioni (ad esempio, elettroni) in un atomo. Possono avere lo stesso insieme di numeri quantici, quindi devono "accumularsi" a livelli di energia più elevati.
Il modo in cui gli elettroni si accumulano è un problema di configurazione di elettroni.
Gli atomi stabili hanno tanti elettroni quanti sono i protoni nel nucleo. Gli elettroni si incontrano intorno al nucleo in orbitali quantistici, seguendo quattro regole di base chiamate principi di Aufbau.
Può servirti: cloruro di bario (bacl2)1. Non ci sono due elettroni nell'atomo condiviso dagli stessi quattro numeri quantici N, L, M e S.
2. Gli elettroni occuperanno prima gli orbitali del livello di energia più basso.
3. Gli elettroni riempiranno sempre gli orbitali con lo stesso numero di spin. Quando gli orbitali sono pieni, inizierà.
4. Gli elettroni riempiranno gli orbitali per la somma dei numeri quantici N e L. Gli orbitali con valori uguali (n + l) verranno riempiti prima con valori N più bassi.
La seconda e la quarta regola sono sostanzialmente le stesse. Un esempio di regola quattro sarebbe orbitali 2p e 3s.
Un orbitale 2p è n = 2 e l = 2 e un orbitale 3s è n = 3 e l = 1. (N + l) = 4 in entrambi i casi, ma l'orbitale 2p ha l'energia più bassa o il valore inferiore e verrà riempito prima dello strato 3s.
Fortunatamente, puoi usare il diagramma Moeller mostrato per riempire gli elettroni. Il grafico viene letto eseguendo le diagonali da 1s.
 Diagramma Moeller. Fonte: Gabriel Bolívar
Diagramma Moeller. Fonte: Gabriel Bolívar Ora che è noto che l'ordine degli orbitali è riempito, l'unica cosa che rimane è memorizzare le dimensioni di ciascun orbitale.
Gli orbitali hanno 1 possibile valore di ml Per contenere 2 elettroni
I p orbitali hanno 3 possibili valori di ml Per contenere 6 elettroni
Gli orbitali hanno 5 possibili valori di ml Per contenere 10 elettroni
Gli orbitali f hanno 7 possibili valoril Per contenere 14 elettroni
Questo è tutto ciò che è necessario per determinare la configurazione elettronica di un atomo stabile di un elemento.
Ad esempio, prendi l'elemento di azoto. L'azoto ha sette protoni e, quindi, sette elettroni. Il primo orbitale da riempire è l'orbitale 1S.
Una S orbitale ha due elettroni, quindi sono rimasti cinque elettroni. Il prossimo orbitale è l'orbitale 2S e contiene i due successivi. I tre elettroni finali andranno all'orbitale 2p che può contenere fino a sei elettroni.
Può servirti: carbossimetilcellulosaImportanza della configurazione elettronica esterna
Le configurazioni di elettroni svolgono un ruolo importante nel determinare le proprietà dell'atomo.
Tutti gli atomi dello stesso gruppo hanno la stessa configurazione elettronica esterna ad eccezione del numero atomico N, motivo per cui hanno proprietà chimiche simili.
Alcuni dei fattori chiave che influenzano le proprietà atomiche includono la dimensione dei più grandi orbitali occupati, l'energia dei più orbitali energetici, il numero di posti vacanti orbitali e il numero di elettroni negli orbitali di una maggiore energia.
La maggior parte delle proprietà atomiche può essere correlata al grado di attrazione tra gli elettroni esterni al nucleo e il numero di elettroni nello strato di elettroni più esterni, il numero di elettroni di valenza.
Gli elettroni dello strato esterno sono quelli che possono formare legami chimici covalenti, che hanno la capacità di ioni di formare cationi o anioni e quelli che danno lo stato di ossidazione agli elementi chimici.
Determineranno anche il raggio atomico. Man mano che N diventa più grande, il raggio atomico aumenta. Quando un atomo perde un elettrone, ci sarà una contrazione del raggio atomico a causa della diminuzione del carico negativo attorno al nucleo.
Gli elettroni dello strato esterno sono presi in considerazione dalla teoria dei collegamenti di Valencia, dalla teoria del campo cristallino e dalla teoria orbitale molecolare per ottenere le proprietà delle molecole e le ibridazioni dei legami.
Riferimenti
- Aufbau Main. Chimica recuperata.Librettexts.org.
- Bozeman Science. Configurazione elettronica. Recuperato da YouTube.com.
- Configurazioni di elettroni e proprietà degli atomi. Recuperato da Oneonta.Edu.

