Caratteristiche, formazione, esempi
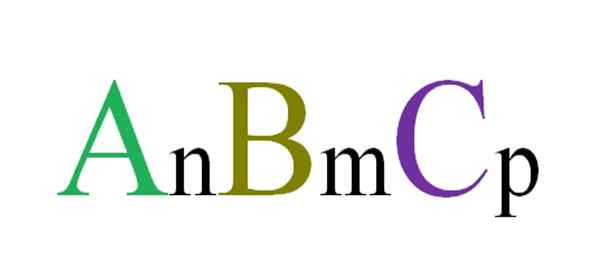
- 3386
- 284
- Dott. Rodolfo Gatti
IL Composti ternari Sono tutti quelli che sono costituiti da tre atomi o ioni diversi. Possono essere molto diversi, dalle sostanze acide o di base, a leghe di metallo, minerali o materiali moderni. I tre atomi possono appartenere allo stesso gruppo della tabella periodica o procedere con posizioni arbitrarie.
Tuttavia, affinché il composto ternario si verifichi ci deve essere un'affinità chimica tra i suoi atomi. Non tutti sono compatibili tra loro, e quindi non puoi semplicemente scegliere in modo casuale quali tre integreranno e definiscono il composto o la miscela (supponendo la mancanza di legami covalenti).
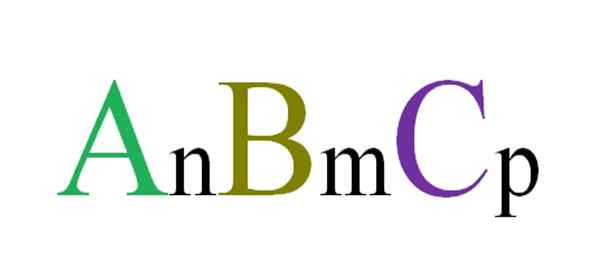 Formula generale e casuale per i composti ternari. Fonte: Gabriel Bolívar.
Formula generale e casuale per i composti ternari. Fonte: Gabriel Bolívar. Ad esempio, vengono scelte tre lettere in modo casuale che governerà un composto ternario ABC (immagine superiore). Gli abbonamenti N, M e P indicano le relazioni stechiometriche tra atomi o ioni A, B e C. Variando i valori di tali abbonamenti e si ottengono le identità delle lettere, infiniti composti ternari.
Tuttavia, formula ANBMCP Sarà valido solo se soddisfa l'elettroneutralità; Cioè, la somma delle tue spese deve essere uguale a zero. Con questo in mente, ci sono limiti fisici (e chimici) che guidano se è possibile la formazione di detto composto ternario.
[TOC]
Caratteristiche dei composti ternari
Le sue caratteristiche non sono generali ma variano a seconda della natura chimica. Ad esempio, oxoacidi e basi sono composti ternari e ognuno di essi condivide o meno una serie di caratteristiche rappresentative.
Ora, prima di un ipotetico composto ABC, questo può essere ionico se le differenze di elettronegatività tra A, B e C non sono grandi; o covalente, con collegamenti a-b-c. Questi ultimi sono riportati in esempi infiniti all'interno della chimica organica, come con alcoli, fenoli, eteri, carboidrati, ecc., le cui formule possono essere descritte con cNHM OP.
Può servirti: proprietà meccaniche dei metalliPertanto, le caratteristiche sono molto varie e oscillate nell'alto grado di un composto ternario a un altro. Il composto cNHMOP Si dice che sia ossigenato; mentre cNHMNP, D'altra parte, è azoto (è un'ammina). Altri composti possono essere zolfo, fosforiti, fluritati o avere un marcato carattere metallico.
Basi e acidi
Avanzando nel campo della chimica inorganica, hai basi di metallo, mNOMHP. Dare.
Ad esempio, la base NaOH, considerando tali abbonamenti, dovrebbe essere scritta come NA1O1H1 (che sarebbe caotico). Inoltre, si presume che h sia come un catione h+, E non come appare veramente: far parte di anione oh-. A causa dell'azione di oh- Sul pelle, queste basi sono saponi e caustiche.
Le basi metalliche sono sostanze ioniche e sebbene siano costituite da due ioni, mN+ e oh- (N / a+ e oh- Per il NaOH), sono composti ternari per avere tre atomi diversi.
Gli acidi, d'altra parte, sono covalenti e la loro formula generale è Hao, dove di solito si trova un atomo non metallico. Tuttavia, data la sua facilità di ionizzato in idrogeni che rilasciano acqua, i suoi ioni H+ Corroen e ferito la pelle.
Nomenclatura
Come le caratteristiche, la nomenclatura dei composti ternari è molto variata. Per questo motivo, solo solo le basi, gli oxoacidi e gli ossisali saranno considerati superficialmente.
Basi
Le basi metalliche sono menzionate per prime con la parola "idrossido" seguito dal nome del metallo e dalla sua valenza in numero romano tra parentesi. Pertanto, NaOH è idrossido di sodio (I); Ma poiché il sodio ha una valenza unica di +1, rimane semplicemente come idrossido di sodio.
Può servirti: AlceansAL (OH)3, Ad esempio, è idrossido di alluminio (III); e cu (oh)2, Copper Idrossido (II). Naturalmente, tutto secondo la nomenclatura sistematica.
Oxoacidi
Gli oxóacidi hanno una formula abbastanza generale del tipo HAO; Ma in realtà, sono meglio descritti come AOH. Il collegamento di Ha-H emerge l'H viene rilasciato+.
La nomenclatura tradizionale è la seguente: la parola "acido" inizia, seguita dal nome dell'atomo centrale, preceduto o preceduto dai rispettivi prefissi (ipo, per) o suffissi (orso, ICO) a seconda che lavora con i suoi minori o valenze più antiche.
Ad esempio, gli oxoacidi di bromo sono HBRO, HBRO2, HBRO3 e hbro4. Questi sono acidi: ipobroma, bromico, bromico e perbromico, rispettivamente. Si noti che in tutti loro ci sono tre atomi con valori diversi per i loro abbonamenti.
Oxisals
Chiamati anche sali di nullion, sono i più rappresentativi dei composti ternari. L'unica differenza di menzionarli è che i sufijos Bear e ICO cambiano rispettivamente per Ito e ATO. Inoltre, H è sostituito da un catione metallico, prodotto della neutralizzazione a base di acido.
Continuando con il bromo, i suoi ossisali di sodio sarebbero: Nabro, Nabro2, Nabro3 e Nabro4. I loro nomi sarebbero diventati: hipobromito, bromito, bromatico e perbromato di sodio. Senza dubbio, il numero di possibili ossisali supera quello degli oxoacidi.
Formazione
Ancora una volta, ogni tipo di composto ternario ha una propria origine o un processo di formazione. Tuttavia, è giusto menzionare che questi possono essere formati solo se esiste una sufficiente affinità tra i tre membri degli atomi. Ad esempio, esistono basi metallici grazie alle interazioni elettrostatiche tra cationi e OH-.
Può servirti: acido citricoQualcosa di simile accade con gli acidi, che non si poteva formare se non esisteva un tale legame covalente A-O-H.
In base alla domanda, come si formano i composti principali? La risposta diretta è la seguente:
- Le basi metalliche sono formate dissolvendo gli ossidi metallici in acqua o in una soluzione alcalina (solitamente fornita da NaOH o ammoniaca).
- Gli oxoacidi sono il prodotto della dissoluzione degli ossidi non metallici in acqua; Tra questi, il CO2, Clo2, NO2, SW3, P4O10, eccetera.
- E poi, gli ossisali sorgono quando gli oxoacidi sono alcalizzati o neutralizzati con una base metallica; Da esso arrivano i cationi metallici che fornino H+.
Altri composti ternari si formano seguendo un processo più complicato, come con determinate leghe o minerali.
Esempi
Infine, una serie di formule per diversi composti ternari verrà mostrata come un elenco:
- Mg (oh)2
- CR (OH)3
- Kmno4
- N / a3Bo3
- CD (OH)2
- Fratello maggiore3
- Feaso4
- Bacr2O7
- H2SW4
- H2Teo4
- Hcn
- Fa
Altri esempi meno comuni (e persino ipotetici) sono:
- Cofecu
- Algasn
- Ucapb
- Bemgo2
Gli abbonamenti N, M e P sono stati omessi in modo da non complicare le formule; Sebbene in realtà, i suoi coefficienti stechiometrici (tranne il meglio per il Bemgo2), può anche avere valori decimali.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- SIG.RA. Hilfstein. (S.F.). Ternary Comununds. Recuperato da: Tenafly.K12.NJ.noi
- Wikipedia. (2019). Ternary Comund. Recuperato da: in.Wikipedia.org
- Carmen Bello, Arantxa Isasi, Ana Puerto, Germán Tomás e Ruth Vicente. (S.F.). Composti ternari. Recuperato da: iesdmjac.Educa.Aragona.È
- « Caratteristiche dei composti quaternari, formazione, esempi
- Caratteristiche dei composti speciali, formazione, usi »

