Caratteristiche dei composti quaternari, formazione, esempi
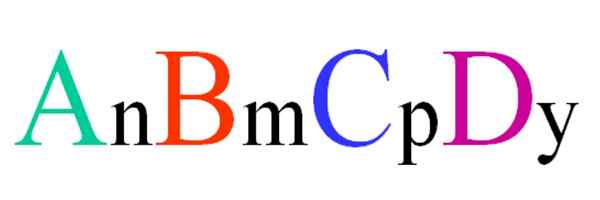
- 3536
- 535
- Enzo De Angelis
IL Composti quaternari Sono tutti quelli che hanno quattro atomi o ioni diversi. Pertanto, possono essere specie molecolari o ioniche. Le sue diversità coprono sia la chimica organica che inorganica, essendo un gruppo molto voluminoso; Anche se forse, non tanto rispetto ai composti binari o ternari.
Il motivo per cui il tuo numero è più piccolo è perché i quattro atomi o ioni devono essere tenuti uniti dalle loro affinità chimiche. Non tutti gli elementi sono compatibili tra loro e anche meno se considerati un quartetto; All'improvviso un paio di loro sono più correlati tra loro che con l'altra coppia.
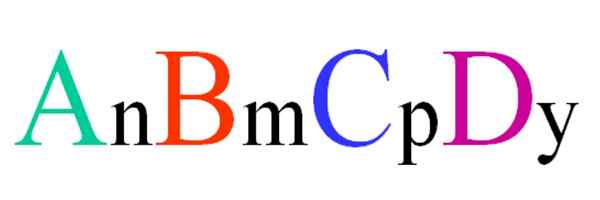 Formula generale e casuale per un composto quaternario. Fonte: Gabriel Bolívar.
Formula generale e casuale per un composto quaternario. Fonte: Gabriel Bolívar. Considera un composto quaternario di formula casuale ABCD. Gli abbonamenti n, m, p e y, sono i coefficienti stechiometrici, che a loro volta indicano quale percentuale di ciascun atomo c'è in relazione agli altri.
Pertanto, formula ANBMCPDE Sarà valido se soddisfa l'elettroneutralità. Inoltre, un tale composto sarà possibile se i loro quattro atomi sono abbastanza vicini tra loro. Si vedrà che questa formula non si applica a molti composti, ma soprattutto per leghe o minerali.
[TOC]
Caratteristiche dei composti quaternari
Sostanze chimiche
Un composto quaternario può essere ionico o covalente, esibendo le caratteristiche previste per la sua natura. I composti ionici ABCD dovrebbero essere solubili in acqua, alcoli o in altri solventi polari; Devono avere alti punti di ebollizione e fusione ed essere buoni driver di elettricità quando si fondono.
Per quanto riguarda i composti covalenti ABCD, la maggior parte è costituita da composti organici di azoto, ossigenati o alogenati; Cioè, la sua formula diventerebbe CNHMOPNE o cNHMOPXE, X essendo un atomo alogeno. Di queste molecole sarebbe logico pensare di essere polari, date le elevate elettronegatività di O, N e X.
Può servirti: cloruro di sodio (NaCl)Un composto ABCD puramente covalente può avere molte possibilità di collegamento: A-B, B-C, D-A, ecc., A seconda delle affinità e delle capacità elettroniche degli atomi. Mentre in un composto ABCD puramente ionico, le sue interazioni sono elettrostatiche: a+B-C+D-, Per esempio.
Nel caso di una lega, considerata più una miscela solida che un composto correttamente parlando, ABCD è costituito da atomi neutri negli stati basali (in teoria).
Del resto, un composto ABCD può essere neutro, acido o di base, a seconda dell'identità dei suoi atomi.
Fisico
Dal punto di vista fisico, è probabile che ABCD non diventa un gas, perché quattro atomi diversi coinvolgono sempre una massa molecolare maggiore o formula. Se non è un liquido con un punto di ebollizione elevato, dovrebbe essere solido, la cui decomposizione deve generare molti prodotti.
Ancora una volta, i suoi colori, odore, consistenza, cristalli, ecc., Saranno soggetti a come coesistono a, b, c e d nel composto e dipenderanno dalla loro sinergia e dalle loro strutture.
Nomenclatura
Finora il problema dei composti quaternari è stato affrontato in modo globale e impreciso. Lasciando da parte la chimica organica (Amidas, cloruri di benechilo, sali di ammonio quaternario, ecc.), In chimica inorganica ci sono esempi ben definiti chiamati ossisali acidi e di base.
Oxisal acidi
Gli ossisali acidi sono quelli che derivano dalla parziale neutralizzazione di un oxoacido poliprotico. Pertanto, uno o più dei suoi idrogeni sono sostituiti da cationi metallici e l'idrogeno meno residuo possiede, meno acido sarà.
Ad esempio, acido fosforico, h3Po4, Per dire, è possibile ottenere fino a due sali acidi. Questi sono: nah2Po4 (N / a+ Sostituisce un idrogeno equivalente a H+) e na2HPO4.
Può servirti: selenio: storia, proprietà, struttura, ottenimento, usiSecondo la nomenclatura tradizionale, questi sali sono nominati così come gli oxisal (totalmente non protetti), ma che precedono la parola "acido" al nome del metallo. Quindi, il nah2Po4 Sarebbe il sodio DEASE Fosfato e il NA2HPO4 Fosfato di acido sodio (perché ha una H ha.
D'altra parte, la nomenclatura di serie preferisce usare la parola "idrogeno" che "acido". Il nah2Po4 Sarebbe essere diidrogeno di sodio e Na2HPO4 Fosfato di sodio idrogeno. Si noti che questi sali hanno quattro atomi: Na, H, P e O.
Oxisal di base
Gli ossisali di base sono quelli che contengono anioni oh nella loro composizione-. Ad esempio, considera Salt Cano3Oh (CA2+ NO3- OH-). Per nominarlo, sarebbe sufficiente dare la parola "di base" al nome del metallo. Quindi, il suo nome sarebbe: nitrato di calcio di base. E che ne dici di Cuio3OH? Il suo nome sarebbe: Cupric Basic Yodale (Cu2+ Io3- OH-).
Secondo la nomenclatura delle scorte, la parola "base" è sostituita dall'idrossido, seguita dall'uso di una sceneggiatura prima del nome dell'osso.
Ripetendo gli esempi precedenti i loro nomi sarebbero per ognuno: idrossido-nitrato di calcio e idrossido-anodaggio di rame (II); Ricordando che il valencia in metallo deve essere indicato tra parentesi e con numero romano.
Doppi sali
In doppi sali ci sono due diversi cationi che interagiscono con lo stesso tipo di anione. Supponiamo che il doppio sale: Cu3Fede (Po4)3 (Cu2+ Fede3+ Po43-). È un fosfato di ferro e rame, ma il nome più appropriato per riferirsi a questo è: fosfato triplo di rame (II) e ferro (iii).
Sali idratati
Questi sono idrati e l'unica differenza è che alla fine dei loro nomi viene specificato il numero di formulazioni d'acqua. Ad esempio, l'MNCL2 È cloruro di manganese (II).
Può servirti: benzoine: struttura, proprietà, usi e rischiIl suo idrato, mncl2· 4h2O Si chiama cloruro di manganese (II) tetraidrato. Si noti che ci sono quattro atomi diversi: Mn, Cl, H e O.
Un famoso sale doppio e idratato è Mohr's, Faith (NH4)2(SW4)2· 6h2O. Il suo nome è: doppio solfato di ferro (ii) ed ammonio esaidrato.
Formazione
Ancora una volta, concentrandoci sui composti quaternari inorganici, abbiamo principalmente un prodotto di neutralizzazioni parziali. Se questi si verificano in presenza di diversi ossidi di metallo, sono probabili i doppi sali; E se il mezzo è molto semplice, gli ossisali di base precipiteranno.
E se inoltre, d'altra parte, le molecole d'acqua hanno un'affinità per il metallo, si coordinano direttamente con esso o con gli ioni circostanti, formando gli idrati.
Sul lato delle leghe, quattro diversi metalli o metalloidi devono essere saldati per la produzione di condensatori, semiconduttori o transistor.
Esempi
Infine, è mostrato un elenco con diversi esempi di composti quaternari. Il lettore può usarlo per testare la sua conoscenza della nomenclatura:
- PBCO3(OH)2
- CR (HSO4)3
- Nahco3
- ZniOh
- Cu2(OH)2SW3
- Li2Kaso4
- Cuso4· 5h2O
- Agau (così4)2
- Caso4· 2h2O
- Fecl3· 6h2O
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Nomenclatura e formulazione inorganica. [PDF]. Estratto da: risorse.formazione scolastica.È
- Erika Thalîa buono. (2019). Doppi sali. Accademia. Recuperato da: Accademia.Edu
- Wikipedia. (2019). Catione di ammonio quaternario. Recuperato da: in.Wikipedia.org

