Struttura del cloruro di ferro (III), proprietà, ottenimento, usi
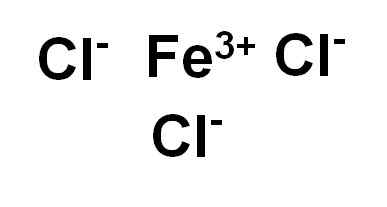
- 1432
- 331
- Lidia Valentini
Lui Cloruro di ferro (III) È un composto inorganico formato dal ferro (fede) ed elementi di cloro (CL). La sua formula chimica è Fecl3. È un solido cristallino il cui colore può essere da arancione al marrone nerastro.
Il fecl3 È facilmente sciolto in acqua che forma soluzioni acquose acide in cui aumentando il pH rendendole più alcaline.
 Cloruro di ferro (III) o cloruro ferrico Fecl3 solido. Егор оси/cc BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0). Fonte: Wikimedia Commons.
Cloruro di ferro (III) o cloruro ferrico Fecl3 solido. Егор оси/cc BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0). Fonte: Wikimedia Commons. Il cloruro di ferro (III) viene utilizzato per sedimentare le particelle che inquinano acque reflue municipali o industriali. Si dice che ti consenta di rimuovere alcuni parassiti e servire a fermare le perdite di sangue dagli animali negli animali e per la guarigione di questi.
Serve a estrarre rame (ii) di minerali di solfuro di rame. Viene anche usato in varie reazioni chimiche e analisi dei laboratori biologici e chimici. Ad esempio, serve a rilevare i composti come fenoli negli oli estratti dalle piante. Viene utilizzato nei circuiti elettronici, nel conciatore in pelle e nella fotografia.
Per essere il FECL3 Un composto acido è corrosivo per la pelle e le mucose. La polvere di questo composto deve essere evitata. Non dovrebbe essere scartato nell'ambiente.
[TOC]
Struttura
Cloruro di ferro (III) o cloruro ferrico Fecl3 È un composto ionico ed è formato da una fede ferrica3+ e tre ioni cloruro CL-. Il ferro è nel suo stato di ossidazione di +3 e ogni cloro ha Valencia -1.
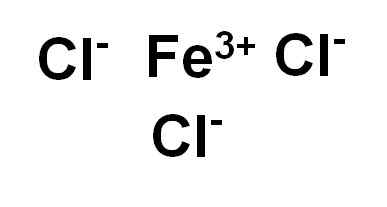 Cloruro di ferro (III) o cloruro ferrico. Autore: Marilú Stea.
Cloruro di ferro (III) o cloruro ferrico. Autore: Marilú Stea. Nomenclatura
- Cloruro di ferro (III)
- Cloruro ferrico
- Tricloruro di ferro
- Iron Muriature
Proprietà
Stato fisico
Orance solido cristallino a marrone nerastro.
 Fecl di cloruro ferrico3 anidro (senza acqua). LeIEM/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0). Fonte: Wikimedia Commons.
Fecl di cloruro ferrico3 anidro (senza acqua). LeIEM/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0). Fonte: Wikimedia Commons. Peso molecolare
Anhidro fecl3 = 162,2 g/mol
Punto di fusione
Anhidro fecl3 = 304 ºC
Esaidrato fecl3 •6h2O = 37 ° C
Punto di ebollizione
Anhidro fecl3 = Circa 316 ºC
Esaidrato fecl3 •6h2O = 280-285 ° C
Densità
Anhidro fecl3 = 2,90 g/cm3 a 25 ° C
Solubilità
Molto solubile in acqua: 74,4 g/100 g di acqua a 0 ° C; 535,7 g/100 g di acqua a 100 ° C. Molto solubile in acetone, etanolo, etere e metanolo. Debolmente solubile in solventi non polari come benzene ed esano.
Può servirti: boro: storia, proprietà, struttura, usiph
Le sue soluzioni acquose sono molto acide. Una soluzione di 0,1 moli di FECL3 per litro di acqua ha un pH di 2,0.
Proprietà chimiche
Quando il FADL si dissolve in acqua3 È idrolizzato; cioè, si separa nei suoi ioni di fede3+ e 3 cl-. Fede3+ Forma lo ione Hexaacuohierro [Faith (H2O)6"3+ Ma questo è combinato con ioni oh- dell'acqua che forma specie miste e di rilascio di protoni H+.
Per questo motivo le loro soluzioni sono acide. Se il pH sta aumentando, queste specie formano un gel e infine si forma un precipitato o solido di fede ad ossido ferrico idratato2O3 •NH2O.
I cristalli di cloruro di ferro (III) sono igroscopici, cioè assorbono l'acqua dall'ambiente. Quando è bagnato è corrosivo per l'alluminio e molti metalli.
 Soluzioni FECL3 Possono essere molto acidi e corrosivi, perché contengono HCL. Kanesskong/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0). Fonte: Wikimedia Commons.
Soluzioni FECL3 Possono essere molto acidi e corrosivi, perché contengono HCL. Kanesskong/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0). Fonte: Wikimedia Commons. Soluzioni acquose di fecl3 Sono molto acidi e corrosivi per la maggior parte dei metalli. Hanno un odore debole di acido cloridrico HCl. Quando il FECL viene riscaldato fino alla sua decomposizione3 emette gas HCL altamente tossici.
Ottenimento
Il cloruro di ferro (III) è prodotto mediante clorazione diretta del ferro reagendo il cloro secco (CL2) Con scarto di ferro (fede) a 500-700 ° C.
La reazione viene eseguita in un reattore resistente all'acido. Il primo passo è sciogliere a 600 ° C una miscela di cloruro di ferro (III) (FECL3) e cloruro di potassio (KCL).
 Il fecl3 Deve essere preparato in contenitori molto resistenti ad acidi come l'acciaio inossidabile. Autore: Johannes Plenio. Fonte: Pixabay.
Il fecl3 Deve essere preparato in contenitori molto resistenti ad acidi come l'acciaio inossidabile. Autore: Johannes Plenio. Fonte: Pixabay. Quindi lo scarto di ferro (fede) viene sciolto in quella miscela fusa in cui il ferro reagisce con la FECL3 E diventa cloruro ferroso (Fecl2).
Fe + 2 Fecl3 → 3 Fecl2
Quindi il fecl2 reagisce con il cloro CL2 Formando il FECL3 che sublima (passa dallo stato solido al gassoso direttamente) e viene raccolto in camere di condensazione speciali.
2 fecl2 + Cl2 → 2 Fecl3
Puoi anche reagire Feso Solfato ferroso4 con cloro cl2.
Esaidrato fecl3 •6h2O Può essere ottenuto evaporando una soluzione acquosa di ioni di fede3+ e cl- In un bagno a vapore.
Può servirti: composti quaternari: caratteristiche, formazione, esempiPresenza in natura
Il cloruro ferrico o il cloruro di ferro (III) si trova nella forma nella forma del minerale mo -minerale, che si trova nella lava dei fumaroli vulcani attivi. Tra i vulcani dove puoi trovare c'è il monte vesubio.
 Il fecl3 Fa parte del minerale Moysite che è nei vulcani attivi. Autore: Skeze. Fonte: Pixabay.
Il fecl3 Fa parte del minerale Moysite che è nei vulcani attivi. Autore: Skeze. Fonte: Pixabay. Applicazioni
Nel trattamento delle acque reflue
Il cloruro ferrico viene utilizzato per trattare le acque reflue municipali o industriali attraverso la sedimentazione chimica.
Agisce come un coagulante che favorisce l'Unione di diverse particelle tra loro, in questo modo si formano conglomerati o particelle più grandi che tendono a flocculari o sedimenti (abbassando il proprio peso sul fondo dell'acqua che viene trattata).
 Il fecl3 Viene utilizzato per separare i materiali indesiderati dalle acque scartate dalle comunità o dalle industrie. Autore: 后园 卓. Fonte: Pixabay.
Il fecl3 Viene utilizzato per separare i materiali indesiderati dalle acque scartate dalle comunità o dalle industrie. Autore: 后园 卓. Fonte: Pixabay. In questo modo è favorita la separazione dei solidi d'acqua e questo è privo di materiali indesiderati.
Questo tipo di trattamenti può facilitare la rimozione di parassiti, come i protozoi, che sono microrganismi formati da una singola cellula, come Amibas, che causano malattie.
Per questo motivo la FECL3 Viene anche usato per purificare l'acqua.
Nelle procedure di guarigione veterinaria
Il cloruro di ferro (III) viene utilizzato per curare le lesioni degli animali.
Serve come astringente locale (è possibile ritirare i tessuti e fungere da anti -infiammatorio e guarigione) ed emostatico (smette di sanguinare o perdite di sangue).
Viene usato nelle polveri per fermare le perdite di sangue o quando i cavalli sono stati tagliati nei bovini. Viene anche usato in una soluzione per fermare il sanguinamento quando vengono tagliati gli artigli o le verruche vengono eliminate.
 Il fecl3 Viene utilizzato nelle polveri applicate alle corna tagliate le mucche ed evitare le infezioni. Autore: Jaclou DL. Fonte: Pixabay.
Il fecl3 Viene utilizzato nelle polveri applicate alle corna tagliate le mucche ed evitare le infezioni. Autore: Jaclou DL. Fonte: Pixabay. Viene anche usato per trattare la faringite (infiammazione di faringe) o la stomatite (infiammazione della mucosa orale) e per aumentare l'emoglobina nel sangue in alcuni uccelli.
Nell'estrazione del metallo
Cloruro di ferro (III) o cloruro ferrico Fecl3 Viene utilizzato per estrarre il rame (ii) di minerale di rame contenente solfuri di detto metallo.
Può servirti: idrossidiÈ un metodo ossidativo adeguato per evitare il rilascio di biossido di zolfo a gas tossico (così2), perché invece di questo viene generato zolfo (i). Vengono prodotte soluzioni con alte concentrazioni di FECL2, Fecl3, Cucl2 e altri cloruri di metallo.
4 fecl3 + Cu2S ⇔ 4 FECL2 + 2 Cucl2 + S ↓
Come reagente di laboratori chimici e biologici
Tra molti dei suoi usi chimici serve per indicare la presenza del gruppo fenolico (cioè il gruppo -oh attaccato a un anello di benzene).
Il composto viene sciolto per essere analizzato in etanolo e vengono aggiunte alcune gocce di soluzione FECL3. Quando il composto ha un gruppo -oh attaccato a un anello di benzene (cioè è un fenolo) si forma una colorazione verde bluastra.
Questo test consente di analizzare la presenza di fenoli negli estratti di piante.
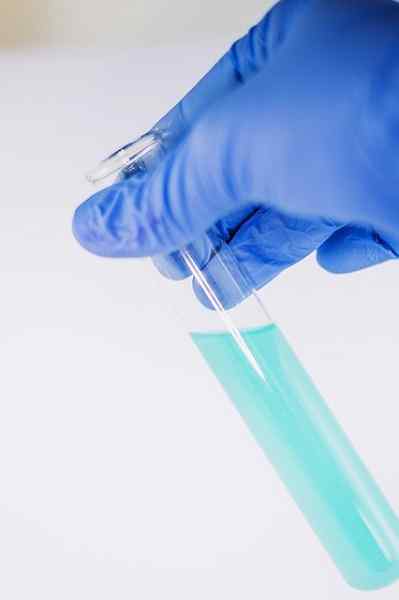 Il fecl3 In presenza di fenoli dà una colorazione verde bluastra. Autore: Ewa Urban. Fonte: Pixabay.
Il fecl3 In presenza di fenoli dà una colorazione verde bluastra. Autore: Ewa Urban. Fonte: Pixabay. Viene anche utilizzato nei test per determinare l'attività antiossidante di alcuni oli estratti dalle verdure.
Un'altra delle sue applicazioni è che consente di preparare altri composti chimici. Può anche fungere da agente ossidante e clorino (fornire cloro) e condensatore (per unirsi a due o più molecole tra loro).
Funge anche da catalizzatore o acceleratore delle reazioni di chimica organica.
In diverse applicazioni
Il cloruro ferrico viene utilizzato nei circuiti elettronici stampati. Dalla colorazione delle sue varie forme idratate, funge da pigmento e viene utilizzato nel conciatore in pelle.
 Il fecl3 È usato in abbronzatura in pelle. Autore: Pexels. Fonte: Pixabay.
Il fecl3 È usato in abbronzatura in pelle. Autore: Pexels. Fonte: Pixabay. È disinfettante. Viene utilizzato per trattare i disturbi della pelle ed è anche usato nella fotografia.
Rischi
Polvere di fecl3 È irritante per gli occhi, il naso e la bocca. Se inalare può causare tosse o difficoltà a respirare. È un composto corrosivo, quindi un contatto prolungato con la pelle e con gli occhi o le mucose possono causare arrossamenti e ustioni.
Non è infiammabile, ma quando riscaldato ad alte temperature produce gas cloruro di idrogeno HCl, che è tossico e molto corrosivo.
Il fecl3 È dannoso per gli organismi acquatici e terrestri. Se per caso viene scartato nell'ambiente, la sua acidità con i composti di base deve essere neutralizzata.
Riferimenti
- O.S. Biblioteca nazionale di medicina. (2019). Cloruro ferrico. Recuperato da Pubchem.NCBI.Nlm.NIH.Gov.
- Kirk-Othmer (1994). Enciclopedia della tecnologia chimica. Volume 19. Quarta edizione. John Wiley & Sons.
- L'enciclopedia di chimica industriale di Ullmann. (1990). Quinta edizione. Volume A22. VCH Verlagsgellschaft MBH.
- Ngameni, b. et al. (2013). Flavonoidi e composti correlati dalle piante medicinali dell'Africa. Caratterizzazione dei flavonoidi negli estratti di piante. Test del cloruro ferrico. Nella ricerca delle piante medicinali in Africa. Recuperato da ScienceDirect.com.
- Agyare, c. et al. (2017). Petroselinum Crispum: una recensione. Attività antiossidante. Nelle sparti medicinali e verdure dall'Africa. Recuperato da ScienceDirect.com.
- Stott, r. (2003). Destino e comportamento dei parassiti nei sistemi di trattamento delle acque reflue. Sedimentazione assistita chimicamente. Nel manuale di acqua e microbiologia delle acque reflue. Recuperato da ScienceDirect.com.
- Tasker, p.A. et al. (2003). Applicazioni di chimica di coordinamento. Estrazione di CuIi Da soluzioni di cloruro. Nella comprensione della chimica del coordinamento. Recuperato da ScienceDirect.com.
- Cotone, f. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- « +125 detti brevi e popolari [con significato]
- 95 detti e detti venezuelani e il loro significato »

