Cloruro di rame (I) (CUCL) Struttura, Proprietà, Usi
- 4765
- 95
- Dott. Rodolfo Gatti
Lui cloruro di rame (i) È un composto inorganico formato da rame (Cu) e cloro (CL). La sua formula chimica è Cucl. Il rame in questo composto ha valencia di +1 e il cloro -1. È un solido cristallino bianco che, se esposto a lungo in aria, acquisisce una colorazione verdastra a causa dell'ossidazione del rame (i) a rame (ii).
Si comporta come acido Lewis che necessita di elettroni di altri composti che sono basi di Lewis, con i quali formano addotti complessi o stabili. Uno di questi composti è il monossido di carbonio (CO), quindi la capacità di unirsi tra loro viene utilizzata a livello industriale per estrarre il CO di bevande analcoliche.
 Cloruro di rame (i) (cucl) purificato. LeIEM/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0). Fonte: Wikimedia Commons.
Cloruro di rame (i) (cucl) purificato. LeIEM/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0). Fonte: Wikimedia Commons. Ha proprietà ottiche che possono essere utilizzate nei semiconduttori che emettono in luce. Inoltre, i nanocubi CUCL hanno un grande potenziale per essere utilizzati in dispositivi energetici efficienti.
È usato nell'arte della pirotecnica perché a contatto con una fiamma produce una luce verde bluastra.
[TOC]
Struttura
Il CUCL è formato dallo ione Cuproso Cup+ e cloruro anionico cl-. La configurazione elettronica dello ione Cu+ È:
1s2 2s2 2 p6 3s2 3p6 3d10 4s0
Ed è perché il rame ha perso l'elettrone dello strato 4S. Lo ione cloruro ha la configurazione:
1s2 2s2 2 p6 3s2 3p6
Si può vedere che entrambi gli ioni hanno i loro strati elettronici completi.
Questo composto cristallizza con simmetria cubica. Nell'immagine sottostante, si osserva la disposizione degli atomi in un'unità cristallina. Le sfere rosa corrispondono alle sfere di rame e verde al cloro.
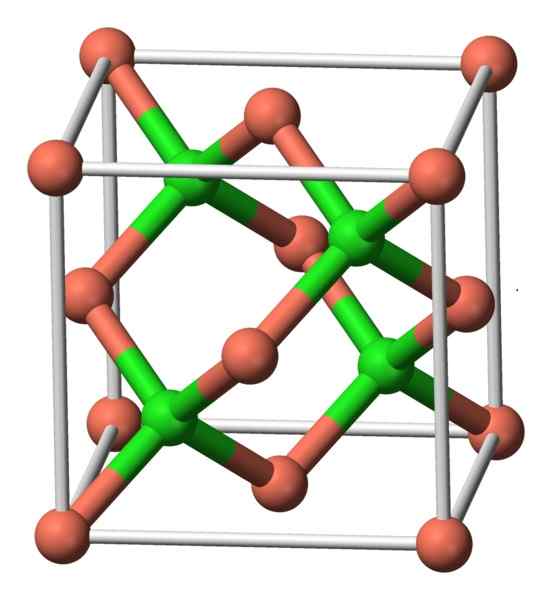 Struttura di Cucl. Autore: Benjah-BMM27. Fonte: Wikimedia Commons.
Struttura di Cucl. Autore: Benjah-BMM27. Fonte: Wikimedia Commons. Nomenclatura
- Cloruro di rame (i)
- Cloruro cuproso
- Monocloruro di rame
Proprietà
Stato fisico
Solido bianco cristallino che nell'aria prolungata con aria è ossidata e diventa verde.
Peso molecolare
98,99 g/mol
Punto di fusione
430 ºC
Punto di ebollizione
Circa 1400 ºC.
Densità
4.137 g/cm3
Solubilità
Quasi insolubile in acqua: 0,0047 g/100 g di acqua a 20 ° C. Insolubile in etanolo (c2H5Oh) e acetone (scegli3(C = o) ch3).
Può servirti: Alilo: unità allyica, carbocalizzazione, radicale, esempiProprietà chimiche
È instabile nell'aria perché Cu+ tende a ossidare Cu2+. Nel tempo, l'ossido cuprico (CUO), l'idrossido cupro (CUOH) o un ossicloruro complesso e il sale vengono trasformati in verde.
 Cloruro di rame (i) che è stato esposto all'ambiente e parzialmente ossidato. CuOh, Cuoh e altri composti possono contenere. Benjah-bmm27 / dominio pubblico. Fonte: Wikimedia Commons.
Cloruro di rame (i) che è stato esposto all'ambiente e parzialmente ossidato. CuOh, Cuoh e altri composti possono contenere. Benjah-bmm27 / dominio pubblico. Fonte: Wikimedia Commons. In soluzione acquosa è anche instabile perché si verifica contemporaneamente una reazione di ossidazione e riduzione, formando il rame metallico e ioni di rame (II):
Cucl → Cu0 + Cucl2
Il Cucl come acido Lewis
Questo composto agisce chimicamente come acido Lewis, il che significa che è ansioso di elettroni, quindi forma addotti stabili con composti che possono fornire loro.
È molto solubile in acido cloridrico (HCl), dove ioni Cl- Si comportano come donatori di elettroni e specie come CUCL2-, Cucl32- e Cu2Cl42-, tra l'altro.
 Questa è una delle specie che si formano nelle soluzioni CUCL in HCL. Autore: Marilú Stea.
Questa è una delle specie che si formano nelle soluzioni CUCL in HCL. Autore: Marilú Stea. Le soluzioni CuCL acquose hanno la capacità di assorbire il monossido di carbonio (CO). Questo assorbimento può verificarsi quando queste soluzioni sono sia acide che neutri o con ammoniaca (NH3).
In tali soluzioni si stima che si formino varie specie come Cu (CO)+, Cuculo)3+, Cuculo)4+, CUCL (CO) e [Cu (CO) CL2"-, che dipende dal mezzo.
Altre proprietà
Ha caratteristiche elettrooptiche, bassa perdita ottica in una vasta gamma di spettro di luce da visibile a infrarosso, basso indice di rifrazione e basso dielettrico costante.
Ottenimento
Il cloruro di rame (I) può essere ottenuto reagendo il rame metallico direttamente con gas di cloro a una temperatura di 450-900 ° C. Questa reazione si applica a livello industriale.
2 cu + cl2 → 2 Cucl
Puoi anche usare un composto riducente come acido ascorbico o biossido di zolfo per passare il cloruro di rame (II) a cloruro di rame (I). Ad esempio, nel caso del SO2, Questo è ossidato in acido solforico.
2 Cucl2 + SW2 + 2 h2O → 2 Cucl + H2SW4 + 2 HCl
Applicazioni
Nei processi di co -retrovery
La capacità delle soluzioni assorbenti e di insormi.
Può servirti: torbidimetriaAd esempio, il processo chiamato cosorb utilizza cloruro di rame stabilizzato sotto forma di sale complesso con alluminio (AnyCL4), che si dissolve in un solvente aromatico come il toluene.
La soluzione assorbe il CO di una corrente gassosa per separarla da altri gas come CO2, N2 e ch4. Quindi la soluzione ricca di monossido viene riscaldata a pressione ridotta (cioè inferiore all'atmosfera) e il CO è esorb. Il gas recuperato in questo modo è alta purezza.
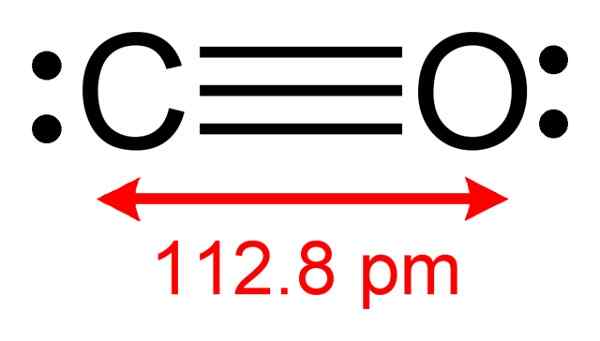 Struttura del monossido di carbonio in cui si osservano gli elettroni disponibili per formare complessi con il CUCL. Autore: Benjah-BMM27. Fonte: Wikimedia Commons.
Struttura del monossido di carbonio in cui si osservano gli elettroni disponibili per formare complessi con il CUCL. Autore: Benjah-BMM27. Fonte: Wikimedia Commons. Questo processo consente di ottenere un CO puro.
Sulla catalisi
Il CUCL è usato come catalizzatore per varie reazioni chimiche.
Ad esempio, la reazione dell'elemento Germanio (GE) con cloruro di idrogeno (HCl) ed etilene (CH2= Ch2) può essere fatto usando questo composto. Serve anche per la sintesi di composti di silicio organico e diversi derivati organici eterociclici di zolfo e azoto.
È possibile sintetizzare un polimero polifenileneter usando un sistema catalitico a 4-amipirina e squat. Questo polimero è molto utile per le sue proprietà meccaniche, un piccolo assorbimento di umidità, un eccellente isolamento dell'elettricità e una resistenza al fuoco.
Nel ottenere composti di rame organico
I composti alkenilcupratati possono essere preparati reagendo un liceo terminale.
Nel ottenere polimeri uniti ai metalli
Il cloruro di rame (I) può essere coordinato con polimeri che formano molecole complesse che fungono da catalizzatori e che combinano la semplicità di un catalizzatore eterogeneo con la regolarità di un omogeneo.
Nei semiconduttori
Questo composto viene utilizzato per ottenere un materiale formato da γ-Corpu sul silicio.
Questi materiali hanno un ampio utilizzo nei diodi emessi alla luce ultravioletta, nei diodi laser e nei rivelatori della luce.
Può servirti: bromuro di potassio (KBR): struttura, proprietà, usiIn super card pisors
Questo prodotto ottenuto sotto forma di nanoparticelle cubiche o di nanocubi consente di produrre supercader, in quanto ha una velocità di carico eccezionale, un'elevata reversibilità e una piccola perdita di capacità.
I supergregoni sono dispositivi per la conservazione dell'energia che si distinguono per la loro alta densità di potenza, il funzionamento nell'operazione, i cicli di carico e scarico rapidi, stabilità a lungo termine e sono ecologici.
 Nanocubos CUCL potrebbe essere utilizzato nelle applicazioni di elettronica e di accumulo di energia. Autore: Tide HE. Fonte: Pixabay.
Nanocubos CUCL potrebbe essere utilizzato nelle applicazioni di elettronica e di accumulo di energia. Autore: Tide HE. Fonte: Pixabay. Altre app
Dare.
 Il colore verde di alcuni fuochi d'artificio può essere dovuto al russare. Autore: Hans Braxmeier. Fonte: Pixabay.
Il colore verde di alcuni fuochi d'artificio può essere dovuto al russare. Autore: Hans Braxmeier. Fonte: Pixabay. Riferimenti
- Milek, j.T. e Neuberger, m. (1972). Cloruro cuprous. In: Materiali modulari elettrooptici lineari. Springer, Boston, MA. Link recuperato.Springer.com.
- Piombo, d.R. (Editor) (2003). Manuale CRC di chimica e fisica. 85th CRC Press.
- Sneeden, r.P.A. (1982). Metodi di assorbimento/disorbimento. In chimica organometallica completa. Volume 8. Recuperato da ScienceDirect.com.
- Cotone, f. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- Chandrashekhar, v.C. et al. (2018). Recenti progressi nella sintesi diretta di composti organometallici e di coordinamento. Nella sintesi diretta di complessi metallici. Recuperato da ScienceDirect.com.
- Kyushin, s. (2016). Sintesi di organosilicon per la costruzione di cluster organosilicon. In metodi efficienti per la preparazione di composti di silicio. Recuperato da ScienceDirect.com.
- Van Koten, G. e Noltes, j.G. (1982). Composti organocopper. In chimica organometallica completa. Volume 2. Recuperato da ScienceDirect.com.
- Danieluk, d. et al. (2009). Proprietà ottiche di film CUCL non drogati e ossigeno drogati su silicio sublati. J Mater Sci: Mater Electron (2009) 20: 76-80. Link recuperato.Springer.com.
- Yin, b. et al. (2014). Nanocubi di cloruro cupRoso coltivati su rame fallimento per elettrodi di pseudocapapa. Nano-Micro Lett. 6, 340-346 (2014). Link recuperato.Springer.com.
- Kim, k. et al. (2018). Un ligando ammina aromatico altamente efficiente/cloruro di rame (i). Polymers 2018, 10, 350. MDPI si è ripreso.com.
- Wikipedia (2020). Cloruro di rame (i). Recuperato da.Wikipedia.org.
- « Frazione molare come viene calcolato, esempi, esercizi
- Ottenimento di grassi butirici, tipi, composizione, usi, benefici »

