Cloruro di alluminio (ALCL3)

- 3272
- 207
- Brigitta Ferrari
 Formula e struttura del cloruro di alluminio
Formula e struttura del cloruro di alluminio Cos'è il cloruro di alluminio?
Lui cloruro di alluminio È un composto chimico inorganico la cui formula è alcl3. È presentato come una polvere solida o bianca, sebbene a causa di una contaminazione con cloruro ferrico e umidità, può diventare giallo. È costituito da un acido Lewis, ma in determinate circostanze si comporta anche come una base di Lewis.
Nonostante l'alluminio come metallo nella tavola periodica, esiste un legame covalente tra alluminio e cloro per formare cloruro di alluminio.
Questo legame covalente potrebbe spiegare perché il cloruro di alluminio fuso è un cattivo conduttore di elettricità; Mentre i sali fusi di altri composti, come il cloruro di sodio, sono buoni conduttori di elettricità.
Il cloruro di alluminio è prodotto da una reazione esotermica tra alluminio e cloro, o cloruro di idrogeno, a una temperatura tra 650 e 750 ºC.
Il cloruro di alluminio è usato come antitraspirante e per combattere la sudorazione eccessiva. Uno dei suoi derivati è usato come agente coagulante nel trattamento delle acque reflue industriali ed è anche usato come catalizzatore principale nelle reazioni chimiche del settore.
Struttura del cloruro di alluminio
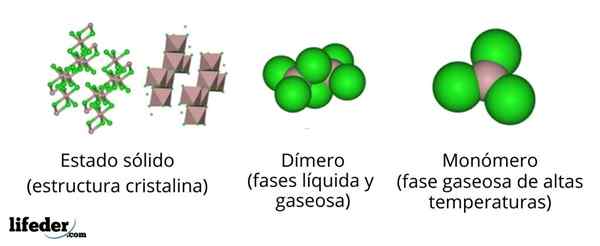
Nell'immagine superiore abbiamo rappresentazioni diverse per ciascuna delle strutture cristalline o molecolari che mostrano il cloruro di alluminio anidro, ALCL3, In molti dei suoi stati fisici.
L'Alcl3 Il solido è costituito da una struttura cristallina monoclinica formata da strati di ottaedros coordinati tra loro. In questi ottaedri (colore marrone), lo ione a3+ È coordinato con sei ioni cl-, Cloruri di recitazione come ponti tra due ottaedri.
Quando la temperatura aumenta e si fonda Alll3, Gli strati sono separati in unità a2Cl6 (Centro di immagini). Ora, l'atomo di alluminio forma si collega a tre atomi di cloro e un legame con l'altro atomo di alluminio: CL3Al-alcl3. Questi dimeri spiegano perché l'ALCL3 fuso è meno denso dei suoi cristalli.
Può servirti: gadolinio: struttura, proprietà, ottenimento, usiNella fase del vapore, i dimeri al2Cl6 Si allontanano l'un l'altro. Ma se questo vapore è sottoposto a temperature elevate, il dimero si dissocia nelle unità molecolari Alcl3, in cui l'atomo di alluminio forma tre collegamenti con atomi di cloro. L'Alcl3 presenta una geometria piatta trigonale.
Proprietà del cloruro di alluminio
 Campione solido di cloruro di alluminio con toni giallastri. Fonte: Xlollitox, CC di 3.0, via Wikimedia Commons
Campione solido di cloruro di alluminio con toni giallastri. Fonte: Xlollitox, CC di 3.0, via Wikimedia Commons Formule
Alcl3 (anidro)
Alcl3· 6h2O (esaidrato)
Massa molare
133.34 g/mol (Anhydro)
241.43 g/mol (esaidrato)
Aspetto fisico
Polvere solida o bianca cristallina. Può diventare una tonalità giallastra a causa della contaminazione con cloruro ferrico. Puoi anche passare a un colore grigiastro per l'umidità.
Punto di fusione
192.4 ºC
Punto di ebollizione
Sublima a 178 ºC, quindi non è facile ottenere il punto di ebollizione del cloruro di alluminio.
Densità
2.48 g/cm3 (anidro)
2.398 g/cm3 (Esaidrato)
Solubilità dell'acqua
439 g/l a 0 ºC
458 g/L a 20 ºC
466 g/l a 30 ºC
Il cloruro di alluminio è un composto igroscopico in grado di assorbire l'acqua dell'aria bagnata, emettendo un fumo durante il processo.
Solubilità in altri solventi
Etanolo Solubile, cloroformio, tetracloruro di carbonio, benzofenone e nitrobenzene. Leggermente solubile in benzene.
Pressione del vapore
13.3 kPa a 151 ºC (0.131 ATM).
Sostanza vischiosa
0.35 cp a 197 ºC
Reattività
Il cloruro di alluminio è una sostanza anfotata, cioè si comporta come un acido o una base. Tuttavia, la sua azione come acido è preponderante, poiché il cloruro di alluminio viene usato come acido Lewis e allo stesso tempo è un catalizzatore in molte reazioni chimiche; Tra questi, la reazione di Friedel-Crafts.
Può servirti: neodimio: struttura, proprietà, usiAnche il cloruro di alluminio è classificato come un acido, invece di farlo come sale.
Il cloruro di alluminio anidro in soluzione acquosa viene trasformato in sale esaidrato (Alcl3· 6h2O), che non ritorna alla forma anidro mediante riscaldamento.
Atomi di alluminio di due molecole ALCL3 Interagiscono tra loro per completare 8 elettroni nel loro strato di valenza, il che si traduce nella formazione del dimero al2Cl6. Questo dimero è presente in cloruro di alluminio fuso e vapore.
Il cloruro di alluminio reagisce con idrossido di sodio per formare idrossido di alluminio, un precipitato gelatinoso:
Alcl3 + NaOH → AL (OH)3 + 3 Nacl
Applicazioni di cloruro di alluminio
Antitraspirante e anti -metarrogico
 Il cloruro di alluminio fa parte degli ingredienti utilizzati nelle formulazioni di diversi deodoranti. Fonte: Th145, CC BY-SA 2.0, via Wikimedia Commons
Il cloruro di alluminio fa parte degli ingredienti utilizzati nelle formulazioni di diversi deodoranti. Fonte: Th145, CC BY-SA 2.0, via Wikimedia Commons Il cloruro di alluminio viene usato come antitraspirante nei deodoranti personali e viene anche usato per controllare la sudorazione eccessiva (iperidrosi). Viene anche usato nelle formulazioni per controllare i piccoli sanguinamenti, come quelli presentati nei trattamenti dentali.
Trattamento delle acque reflue
Il cloruro di alluminio sotto forma di PAC (cloruro di polialumina), viene usato come coagulante nel trattamento delle acque reflue industriali, a causa della sua capacità di chiarire l'acqua e disidrata.
Catalizzatore
Il cloruro di alluminio è uno dei principali catalizzatori utilizzati nel settore, fungendo da catalizzatore in numerose reazioni, tra cui Friedel-Craft.
Può servirti: Europium: struttura, proprietà, ottenimento, usiIl cloruro di alluminio catalizza le reazioni di preparazione degli antraquinoni, alcuni dei quali sono usati nel settore tessile. Ci sono anche antraquinoni che hanno proprietà antibatteriche, antiparasitiche, fungicide e antivirali.
Il cloruro di alluminio catalizza le reazioni prodotte dal dodecilbenzene, utilizzate nella produzione di detergenti e etilbenzene, composto utilizzato nella produzione di polistirene, polimero utilizzato nell'elaborazione di materie plastiche, resine e gomma.
Il cloruro di alluminio è anche usato come catalizzatore in una reazione che fa parte della produzione di benzina ad alto ottano. Allo stesso modo, catalizza il processo di cracking dell'olio.
Rischi
Il cloruro di alluminio è una sostanza corrosiva e il suo contatto può causare irritazione e lesioni alla pelle e agli occhi, producendo danni agli occhi.
Quando si dissolvono nell'acqua, è possibile rilasciare gas velenosi, come l'idrogeno cloruro; gas in grado di inalare un'irritazione del naso e della gola, essendo in grado di causare irritazione dura e polmonare. Questa irritazione può portare all'accumulo di fluido nei polmoni (edema polmonare), che termina in un'emergenza medica.
Ha cercato di stabilire una connessione tra la malattia di Alzheimer e il cloruro di alluminio; Sebbene i risultati della ricerca non siano conclusivi.
Allo stesso modo, è stata studiata la connessione tra l'uso di deodoranti che usano come anti -transpirante per Alll3 e cancro al seno. La ricerca non è stata in grado di dimostrare una relazione conclusiva. In ogni caso, il cloruro di alluminio blocca il funzionamento di un sistema di disintossicazione naturale dell'organismo e delle emissioni di calore, come il sudore.
Riferimenti
- Wikipedia. (2021). Aluminio di cloruro. Recuperato da: in.Wikipedia.org
- National Center for Biotechnology Information (2021). Cloruro Aluminium, Riepilogo composto pubchem per CID 24012. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- NJ Health. (2008). Scheda informativa per sostanze pericolose: cloruro di alluminio. [PDF]. Recuperato da: NJ.Gov
- Britannica Enciclopedia. (2021). Aluminio di cloruro. Recuperato da: Britannica.com
- Elsevier b.V. (2021). Antrachinoni. Scienceirect. Estratto da: ScienceDirect.com
- John p. Cunha. (02 maggio 2020). Alluminio cloruro topico. Recuperato da: rxlist.com

