Struttura della citosina, funzioni, proprietà, sintesi
- 3496
- 258
- Silvano Montanari
IL Citosina È una base di azoto pirimidina, che serve per la biosintesi della citidina-5'-monofosfato e della dexiciidina-5'-monofosfato. Questi composti servono per la biosintesi, rispettivamente, dall'acido desossiribonucleico (DNA) e dall'acido ribonucleico (RNA). Il DNA memorizza informazioni genetiche e l'RNA ha varie funzioni.
Negli esseri viventi, la citosina non si trova liberamente, ma comunemente ribonucleotidi o deossiribonucleotidi. Entrambi i tipi di composti hanno un gruppo di fosfato, un ribosio e una base di azoto.
 Fonte: Vesprcom [dominio pubblico]
Fonte: Vesprcom [dominio pubblico] Il carbonio 2 del ribosio ha un gruppo di ossidrillo (-oh) nei ribonucleotidi e un atomo di idrogeno (-H) nei deossiribonucleotidi. A seconda del numero di gruppi di fosfato presenti, vi è Citidín-5'-Monofosfato (CMP), Citidín-5'-Difosfato (CDP) e Citidín-5'-Triffosfato (CTP) (CTP).
Gli equivalenti desossigeniti sono chiamati deSossicitidin-5'-monofosfato (DCMP), deSossicitidin-5'-difosfato (DCDP) e Desossicitidin-5'-triffosfato (DCTP).
La citosina, nelle sue varie forme, partecipa a diverse funzioni, come la biosintesi del DNA e dell'RNA, la biosintesi delle glicoproteine e la regolazione dell'espressione del gene.
[TOC]
Struttura e proprietà
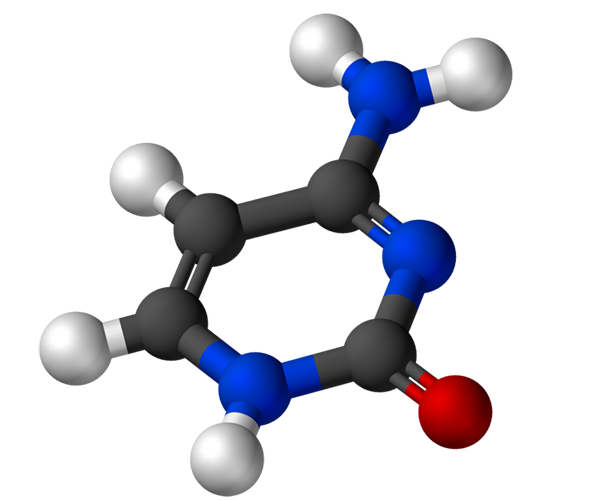
La citosina, 4-amino-2-idrossipirimidina, ha la formula empirica C4H5N3Oppure, il cui peso molecolare è 111,10 g/mol ed è purificato come polvere bianca.
La struttura della citosina è un anello eterociclico, aromatico e planari. La lunghezza d'onda di assorbanza massima (ʎMax) È 260 nm. La temperatura di fusione della citosina supera i 300 ºC.
Per formare un nucleotide, la citosina si lega in modo covalente, attraverso l'azoto 1, mediante mezzi. Il carbonio 5 'viene esterificato con un gruppo di fosfato.
Biosintesi
La biosintesi nucleotidica della pirimidina ha un percorso comune, che consiste in sei gradini catalizzati dagli enzimi. La strada inizia con biosintesi carbamoil-fosfato. In Prokaryotes c'è solo un enzima: Carbamoil fosfato sintasi. Ciò è responsabile della sintesi di pirimidine e glutammina. Negli eucarioti ci sono carbamoil fosfato sintasi I e II, che sono rispettivamente responsabili per la biosintesi di glutammina e pirimidina.
Il secondo passo consiste nella formazione di N-CarbamoilasPartato, dal fosfato di carboidrati e aspartato, reazione catalizzata dal transpartato transcamoilasa (Atcasa).
Il terzo passo è la sintesi di l-diidroto, che produce la chiusura dell'anello della pirimidina. Questo passaggio è catalizzato da Dihydrootase.
Il quarto passo è la formazione di Orotato, che è una reazione redox catalizzata dal diidrooroto deidrogenasi.
La quinta fase consiste nella formazione di Goldilato (OMP) usando il fosforibosil pirofosfato (PRPP) come substrato e il fosforibosil orotato transferasi come catalizzatore come catalizzatore.
Il sesto passo è la formazione di uridilaato (Uridin-5'-monofosfato, UMP), reazione catalizzata da un OMP-Decarbossilasi.
Può servirti: flora e fauna da hidalgoLe seguenti fasi sono costituite dalla fosforilazione dell'UMP, catalizzata dalle chinasi, per formare UTP e il trasferimento di un gruppo amminico dalla glutammina all'UTP per formare CTP, catalizzata dalla reazione da CTP sintetasi.
Regolazione della biosintesi
Nei mammiferi, la regolamentazione avviene al carbamoil fosfato sintasi.
Carbamoil Syntasa II è regolato da un feedback negativo. I suoi regolatori, l'UTP e il PRPP, sono, rispettivamente, inibitore e attivatore di questo enzima.
Nei tessuti che non sono epatici, il carbamoil fosfato sintasi II è l'unica fonte di carbamoil fosfato. Mentre nel fegato, in condizioni di ammoniaca in eccesso, il fosfato sintasi I carbamoil produce, nei mitocondri, il fosfato di carbamoil, che viene trasportato al citosol, da dove entra nel percorso della biosintesi delle pirimidine.
Un altro punto di regolamentazione è OMP-Discarbossilasi, che è regolato dall'inibizione competitiva. Il prodotto della sua reazione, UMP, compete con l'OMP per il sito di legame nell'OMP-Descarbossilasa.
Le pirimidine, come la citosina, vengono riciclate
Il riciclaggio delle pirimidine ha in funzione il riutilizzo delle pirimidine senza la necessità di biosintesi di novo ed evita il percorso degradativo. La reazione di riciclaggio è catalizzata dalla fosforibosiltransferasi pirimimidina. La reazione generale è la seguente:
Pirimidina + prpp -> nucleoside pirimidina 5 ' -monofosfato + ppi
Nei vertebrati, la fosforibosiltransferasi pirimidina si trova negli eritrociti. Il substrato di pirimidine di questo enzima è uracile, timina e orotato. La citosina viene riciclata indirettamente da Uridin-5'-monofosfato.
Funzione nella biosintesi del DNA
Durante la replicazione del DNA, le informazioni contenute nel DNA vengono copiate nel DNA attraverso una DNA polimerasi.
La biosintesi dell'RNA necessita di deossinucleotidi trifosfato (DNTP), vale a dire: trifosfato dexitimide (DTTP), desicitidy triffosfato (DCTP), de -alxyxyadenin trifyse (DATP) e dexiguanina trifosfato (dgtp). La reazione è:
(DNA)n rifiuti + Dntp -> (DNA)N+1 rifiuti + ppi
L'idrolisi del pirofosfato inorganico (PPI) fornisce energia per la biosintesi dell'RNA.
Funzione nella stabilizzazione della struttura del DNA
Nella doppia elica dnus, una purina, di una catena, è collegata alla pirimidina, della catena opposta, da legami idrogeno. Pertanto, la citosina è sempre collegata alla guanina da tre legami idrogeno: l'adenina è collegata alla timina da due legami idrogeno.
Può servirti: importanza della biologiaI legami idrogeno vengono rotti quando una soluzione di DNA nativa purificata a pH 7, è soggetta a temperature superiori a 80 ºC. Questo fa sì che l'elica del doppio DNA formi due catene separate. Questo processo è noto come denaturazione.
La temperatura alla quale è denaturato il 50% del DNA è nota come temperatura di fusione (TM). Molecole di DNA la cui guanina e citosina.
Quanto sopra è il test sperimentale che un numero maggiore di legami idrogeno stabilizza meglio le molecole di DNA native.
Funzione delle regioni ricche nella citosina nel DNA
Recentemente, è stato scoperto che il DNA del nucleo delle cellule umane può adottare strutture di motivi intercalati (IM). Queste strutture sono prodotte nelle regioni di citosina.
La struttura IM è composta da quattro catene di DNA, a differenza del classico DNA a doppia elica che ha due catene. Più specificamente, due catene duplex parallele sono intervallate in un orientamento antiparallela e sono mantenute insieme da una coppia di citosine emiprotonate (C: C:+).
Nel genoma umano, le strutture dell'IM si trovano in regioni come i promotori e i telomeri. Il numero di strutture IM è più elevato durante la fase G1/S del ciclo cellulare, in cui la trascrizione è alta. Queste regioni sono siti di riconoscimento delle proteine coinvolti nell'attivazione dei macchinari trascrizionali.
D'altra parte, nelle regioni ricche di basi di guanina (c) consecutive, il DNA tende ad adottare la forma dell'elica A, in condizioni di disidratazione. Questa forma è tipica dell'RNA e delle doppie bande miste con trascrizione e replicazione, e in determinati momenti in cui il DNA è collegato alla proteina.
È stato dimostrato che le regioni con basi di citosina consecutive creano un patch elettropositivo nella fessura principale del DNA. Pertanto, si ritiene che queste regioni si leghino alle proteine, il che predispone alcune regioni genomiche della fragilità genetica.
Funzione nella biosintesi dell'RNA
Durante la trascrizione, le informazioni contenute nel DNA vengono copiate nell'RNA attraverso un RNA PON polimerasi. La biosintesi dell'RNA necessita di nucleosidi Tryposphate (NTP), vale a dire: Tryphyse citidina (CTP), Tryposphate Uridine (UTP), adenina tripospha (ATP) e trifosfato guanina (GTP). La reazione è:
Può servirti: flora e fauna di Campeche: specie rappresentative(RNA)n rifiuti + Ntp -> (RNA)N+1 rifiuti + ppi
L'idrolisi del pirofosfato inorganico (PPI) fornisce energia per la biosintesi dell'RNA.
Funzione nella biosintesi delle glicoproteine
Il trasferimento sequenziale di esosi per formare gli oligosaccaridi, O-legati alle proteine, avviene dai precursori nucleotidici.
Nei vertebrati, l'ultima fase della biosintesi degli oligosaccaridi ligati O è costituito dall'aggiunta di due rifiuti di acido sinale (N-acetilneuramina) da un precursore di Citidin-5'-monoposfato (CMP). Questa reazione è prodotta nel sacco trans di Golgi.
Trattamenti di citosina e chemioterapia contro il cancro
L'acido tetraidrofolato (FH4) è una sorgente di gruppo -CH3, Ed è necessario per la biosintesi di DTMP da Dump. FH2 è anche formato. La riduzione di FH2 a FH4 richiede un folato e NADPH reduttasi. Alcuni inibitori di folati reduttasi, come l'aminopterina e il metotroxato sono usati nei trattamenti per il cancro.
Metotrexan è un inibitore competitivo. Il folato reduttasi si unisce con 100 volte più affinità con questo inibitore che con il suo substrato. Aminapterine agisce in modo simile.
L'inibizione del folato reduttasi ostacola indirettamente la biosintesi DTMP, e quindi quella di DCTP. L'inibizione diretta avviene attraverso gli inibitori della sintetasi timidilata, che catalizza DTMP da Dump. Questi inibitori sono 5-fluorouracile e 5-fluoro-2-diossiuridina.
Ad esempio, il 5-fluoroacile non è un inibitore ma prima diventa, la via del riciclaggio, nel mofosfato deossiuride D (FDUMP), che si lega alla sintesi timidilata e lo inibisce.
Sostanze analoghe alla glutammina, all'azaserina e all'acivicina, inibiscono la glutammina di amidotransferasi. Azarine è stata una delle prime sostanze scoperte che agiscono come inattivante suicida.
Riferimenti
- Assi, h.A., Garavís, m., González, c., E damha, m.J. 2018. DNA i-motif: caratteristiche strutturali e significato per la biologia cellulare. Ricerca sui nuclei, 46: 8038-8056.
- Bohinski, r. 1991. Biochimica. Addison-Wesley Iberoamericana, Wilmington, Delaware.
- Devlin, t.M. 2000. Biochimica. Redazione editoriale, Barcellona.
- Lodish, h., Berk, a., Zipurski, s.L., Matsudaria, p., Baltimora, d., Darnell, J. 2003. Biologia cellulare e molecolare. Editoriale Medica Panamericana, Buenos Aires, Bogotá, Caracas, Madrid, Messico, Sāo Paulo.
- Nelson, d. L., Cox, m. M. 2008. Leynninger-Principles of Biochemistry. W.H. Freeman, New York.
- Voet, d. e Voet, J. 2004. Biochimica. John Wiley and Sons, USA.

