Caratteristiche della cisteina, struttura, funzioni, biosintesi
- 2301
- 586
- Enzo De Angelis
IL Cisteina (Cys, c) è uno dei 22 aminoacidi presenti in natura come parte delle catene polipeptidiche che compongono le proteine degli esseri viventi. È essenziale per la stabilità delle strutture terziarie delle proteine, in quanto aiuta la formazione di ponti disolfuro intramolecolari.
Così come è vero per altri aminoacidi come alanina, arginina, asparagina, glutammato e glutammina, glicina, prolina, serina e tirosina, gli esseri umani sono in grado di sintetizzare la cisteina, quindi questo non è considerato un aminoacido essenziale essenziale.
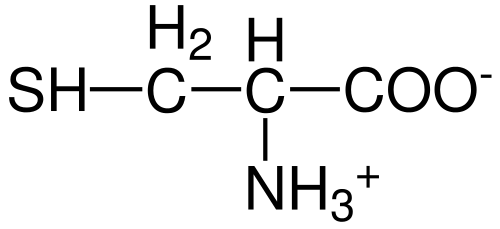
 Struttura di aminoacidi cisteina (fonte: Hattich [dominio pubblico] via Wikimedia Commons)
Struttura di aminoacidi cisteina (fonte: Hattich [dominio pubblico] via Wikimedia Commons) Nonostante ciò, e in considerazione del fatto che i tassi di sintesi non forniscono sempre i requisiti del corpo, alcuni autori descrivono la cisteina come un aminoacido "condizionalmente" essenzialmente ".
Questo aminoacido fu nominato dalla "cistina", un componente dei calcoli vescicolari scoperti nel 1810, il cui nome fu coniato nel 1832 da a. Baudimonont e f. Malaguti. Qualche anno dopo, nel 1884, e. Baumann ha scoperto che la cisteina era il prodotto della riduzione della cistina.
Dopo il lavoro svolto da Bauman, nel 1899, fu determinato che la cisteina è il principale costituente della proteina che forma le corna di vari animali, il che suggeriva il suo possibile uso per la sintesi polipeptidica.
Al momento è noto che la cisteina corporea proviene da cibo, riciclaggio proteico e sintesi endogena, che si verifica principalmente negli epatociti.
[TOC]
Caratteristiche
La cisteina ha un peso molecolare di 121.16 g/mol e si trova, insieme a leucina, isoleucina, valina, fenilalanina, triptofano, metionina e tirosina, tra i più aminoacidi idrofobici.
Appartiene al gruppo di aminoacidi polari senza carico e, come altri aminoacidi, può essere degradato dall'idrolisi alcalina ad alte temperature.
Come triptofano, serina, glicina e treonina, la cisteina è un precursore metabolico per la gluconeogenesi e la chetogenesi (formazione di corpi chetonici).
Questo aminoacido esiste come parte della sequenza peptidica delle proteine, ma può anche essere libero nel plasma nel sangue come disolfuri omogenei (cistina, un derivato) o miscelato, composto dalla forma di omocisteina-cisteina.
La differenza principale tra la cisteina libera e quella trovata nella struttura proteica è che il primo è in uno stato redox molto arrugginito, mentre l'ultimo è di solito abbastanza ridotto.
Struttura
Come per il resto degli aminoacidi descritti fino ad oggi, la cisteina ha un atomo di carbonio centrale, che è chirale ed è noto come carbonio α.
Quattro diverse specie chimiche sono unite a questo atomo di carbonio:
- Un gruppo amino (-nh3+)
- Un gruppo carbossilico (-co-)
- un atomo di idrogeno e
- Un sostituente (-r).
Il gruppo sostituente è quello che dà identità a ciascun aminoacido e quello della cisteina è caratterizzato contenente un atomo di zolfo come parte di un gruppo Tiol O Sulfhydrillo (-Ch2-sh).

È questo gruppo che gli consente di partecipare alla formazione di ponti disolfuro intramolecolari. Dal momento che è un nucleofilo, puoi anche partecipare alle reazioni di sostituzione.
In effetti, questa catena laterale della cisteina può essere modificata per la formazione di due composti noti come "selenocisteina" e "lentionina". Il primo è un aminoacido che partecipa anche alla formazione di proteine e il secondo è un derivato degli aminoacidi non proteici.
Può servirti: istoni: caratteristiche, struttura, tipi e funzioniIl gruppo Tiol di cisteina è anche caratterizzato dalla sua grande affinità con gli ioni argento e mercurio (Ag+ e Hg2+).
Funzioni
Le principali funzioni della cisteina negli organismi viventi hanno a che fare con la loro partecipazione alla formazione di proteine. In particolare, la cisteina partecipa alla creazione di ponti disolfuro, che sono essenziali per la formazione della struttura proteica terziaria.
Inoltre, questo aminoacido non è utile solo per la sintesi proteica, ma partecipa anche alla sintesi del glutatione (GSH) e fornisce zolfo ridotto per metionina, acido lipoico, tiamina, coenzima A (COA), molibdopterina (un cofattore) e altro composti con importanza biologica.
In condizioni di eccessiva quantità di aminoacidi solforti, la cisteina e altri aminoacidi correlati possono essere utilizzati per la produzione di piruvato inorganico e zolfo. Il piruvato riesce a essere reindirizzato verso la via gluconeogena, che serve per la produzione di glucosio.
Le cheratine, che sono uno dei tipi più abbondanti di proteine strutturali nel regno animale, sono ricche di residui di cisteina. Ad esempio, la lana di pecora contiene oltre il 4% di zolfo da questo aminoacido.
La cisteina partecipa anche a molte reazioni di riduzione dell'ossido, quindi fa parte del sito attivo di alcuni enzimi.
Quando reagisce con il glucosio, questo aminoacido genera prodotti di reazione che introducono gusti e aromi attraenti ad alcuni preparati culinari.
Biosintesi
La biosintesi degli aminoacidi nel corpo umano e in quella di altri animali (mammiferi e non mammiferi) avviene in forma di tessuto e classe cellulare; È un processo che merita energia e di solito è separato tra organi diversi.
Il fegato è uno dei principali organi coinvolti nella sintesi della maggior parte degli aminoacidi non essenziali, indipendentemente dalla specie considerata.
In questa non solo la cisteina è sintetizzata, ma anche aspartata, asparagina, glutammato e glutammina, glicina, serina, tirosina e altri dai suoi specifici precursori di aminoacidi.
Nel 1935, il marchio Erwin decise che la cisteina, nei mammiferi, è naturalmente sintetizzata dalla metionina, che si svolge esclusivamente nel tessuto epatico.
Questo processo può verificarsi a causa di un "transmetile" di metionina, in cui i gruppi metilici vengono trasferiti su collina e creatina. Tuttavia, la cisteina può anche essere formata da metionine grazie a una trasulfurazione.
Successivamente è stato dimostrato che, oltre alla metionina, alcuni composti sintetici come n-acetil cisteina, cisteamina e cistamina, sono utili precursori per la sintesi di cisteina.
Nel caso della n-acetil cisteina, questo viene preso dalle cellule, dove viene convertito in cisteina da un enzima del citosol nel citosol.
Meccanismo di sintesi
Il meccanismo di sintesi della cisteina dal metodo più noto è quello di trans -ululo. Ciò si verifica principalmente nel fegato, ma è stato anche determinato nell'intestino e nel pancreas.
Ciò si verifica dall'omocisteina, un composto derivato dalla metodo di aminoacido; E la prima reazione di questa via biosintetica è una condensa catalizzata dall'enzima di cistationina β-sentasi (CBS) (CBS) (CBS).
Può servirti: uracile: struttura, funzioni, proprietà, sintesiQuesto enzima rappresenta il passaggio di "impegno" del percorso e condensa un'omocisteina con un residuo di serina, un altro aminoacido proteico, che produce cistatazione. Successivamente, questo composto viene "tagliato" o "diviso" dall'enzima cistationasa, che porta al rilascio di cisteina.
La regolazione dell'attività enzimatica della CBS è mediata dalla disponibilità della metodo e dallo stato redox della cellula in cui si verifica questo processo.
Attraverso il percorso di sintesi della cisteina, le cellule possono gestire la metodo in eccesso, poiché la loro conversione in cisteina è un processo irreversibile.
Sintesi di cisteina in piante e microrganismi
In questi organismi, la cisteina è sintetizzata principalmente dallo zolfo inorganico, che è la fonte più abbondante di zolfo utilizzabile nella biosfera aerobica.
Questo viene preso, entra nelle cellule e viene quindi ridotto al solfuro (S2-), che è incorporato nella cisteina in modo simile a ciò che accade con ammonio nella sintesi di glutammato o glutammina.
Metabolismo e degrado
Il catabolismo cisteina si verifica principalmente nelle cellule epatiche (epatociti), sebbene possa verificarsi anche in altri tipi di cellule come neuroni, cellule endoteliali e cellule muscolari lisce della vascolarizzazione del corpo.
Alcuni difetti nel catabolismo della cisteina producono una malattia ereditaria nota come "cistinuria", caratterizzata dalla presenza di calcoli di cistina nei reni, nella vescica e nell'uretere.
La cistina è un aminoacido derivato dalla cisteina e i calcoli sono formati dall'unione di due molecole attraverso i loro atomi di zolfo.
Parte del metabolismo della cisteina provoca la formazione di acido scientifico, da cui si forma un aminoacido non proteico. La reazione è catalizzata dall'enzima cisteina di diossigenasa.
Inoltre, la cisteina può essere ossidata dalla formaldeide per produrre cisteina a forma di N, la cui successiva elaborazione può portare alla formazione di "merce" (prodotto della condensazione delle cisteine con composti aromatici).
Negli animali, viene anche usata la cisteina, così come il glutammato e la glutammina, per la sintesi di coenzima A, glutatione (GSH), piruvato, solfato e acido solfiderico.
Uno dei metodi per la conversione dalla cisteina al piruvato si verifica in due fasi: il primo implica la rimozione dell'atomo di zolfo e la seconda una reazione di transaminazione.
I reni sono responsabili dell'escrezione di solfati e solfiti derivati dal metabolismo dei composti di zolfo come la cisteina, mentre i polmoni espirano il biossido di zolfo e l'acido solfidrico.
Glutation
Il glutatione, una molecola formata da tre rifiuti di aminoacidi (glicina, glutammato e cisteina) è una molecola presente in piante, animali e batteri.
Ha proprietà speciali che lo rendono un eccellente "tampone" redox, in quanto protegge le cellule da diversi tipi di stress ossidativo.
Alimenti ricchi di cisteina
La cisteina si trova naturalmente negli alimenti che contiene zolfo come i tuorli (gialli) di uova, peperoni rossi, aglio, cipolle, broccoli, cavolfiore, colliflower, collils e bruxelle.
È anche presente principalmente in alimenti ricchi di proteine come carni, legumi e prodotti lattiero -caseari, tra cui:
Può servirti: ovalbumina: struttura, funzioni, denaturazione- Carne di mucca, maiale, pollo e pesce
- Avena e lenticchie
- Semi di girasole
- Yogurt e formaggio
Benefici dell'assunzione di cisteina
Si ritiene che la sua assunzione impedisca la perdita di capelli e ne stimoli la crescita. Nell'industria alimentare è molto utilizzato come agente di massaggio panificabile e anche per "riprodurre" i sapori simili a carne.
Altri autori hanno sottolineato che l'assunzione di integratori alimentari o alimenti per alimenti diminuisce.
Alcuni integratori nutrizionali relativi alla cisteina sono usati dagli esseri umani come antiossidanti, il che è considerato benefico dal punto di vista del "ritardo" dell'invecchiamento.
La n-acetil cisteina (un precursore nella sintesi della cisteina), ad esempio, è considerato un integratore nutrizionale, poiché ciò comporta un aumento della biosintesi del glutatione (GSH).
Malattie correlate
Esistono alcune pubblicazioni scientifiche che mettono in relazione alti livelli di cisteina plasmatica con l'obesità e altre patologie correlate come le malattie cardiovascolari e altre sindromi metaboliche.
La cistinuria, come menzionato sopra, è una patologia correlata alla presenza di pietre di cistina, un derivato zip, a causa di un difetto genetico nel riassorbimento degli aminoacidi dibasici come la cistina.
Disturbi da carenza
La carenza di cisteina è stata correlata allo stress ossidativo, poiché questo è uno dei principali precursori della sintesi di glutatione. Pertanto, le carenze in questo aminoacido possono portare all'invecchiamento prematuro e a tutti gli appartamenti che ciò significano.
È stato dimostrato sperimentalmente che l'integrazione di cisteina migliora le funzioni del muscolo scheletrico, riduce la relazione tra la massa corporea grasso e non grasso, riduce i livelli plasmatici di citochine infiammatorie, migliora le funzioni del sistema immunitario, ecc.
A metà degli anni '90, alcuni studi hanno suggerito che la sindrome da immunodeficienza acquisita (AIDS) potrebbe essere una conseguenza di una carenza di cisteina indotta da virus.
Queste dichiarazioni sono state supportate dal fatto che i pazienti hi-positivi esaminati avevano bassi livelli di cistina plasmatica e cisteina, oltre a una ridotta concentrazione intracellulare di glutatione.
Riferimenti
- Dröge, w. (1993). Cisteina e carenza di glutatione nei pazienti con AIDS: una logica per il trattamento con N-aciceicil-cisteina. Farmacologia, 46, 61-65.
- Dröge, w. (2005). Stress e invecchiamento ossidativo: sta invecchiando una sindrome di cisteina? Transazioni filosofiche della Royal Society B: Biological Sciences, 360(1464), 2355-2372.
- Elshorbagy, a. K., Smith, a. D., Kozich, v., & Refsum, H. (2011). Cisteina e obesità. Obesità, venti(3), 1-9.
- Kridich, n. (2013). Biosintesi della cisteina. Ecosal Plus, 1-30.
- McPherson, r. A., & Hardy, G. (2011). Benefici clinici e nutrizionali degli integratori proteici arricchiti con cisteina. Opinione attuale nella nutrizione clinica e nella cura metabolica, 14, 562-568.
- Mokhtari, v., Afsharian, p., Shahhoseini, m., Kalantar, s. M., & Moini, a. (2017). Una recensione su vari usi della cisteina N-acetil. Diario cellulare, 19(1), 11-17.
- Pista, p. (2013). Antiossidante per cysteine-master. International Journal of Pharmaceutical, Chemical e Biological Sciences, 3(1), 143-149.
- Quig, d. (1998). Metabolismo della cisteina e tossicità del metallo. Revisione della medicina alternativa, 3(4), 262-270.
- Wu, g. (2013). Amminino. Biochimica e nutrizione. Boca Raton, FL: Taylor & Francis Group.
- « Caratteristiche dell'apprendimento sociale, teoria di bandura, esempi
- Dimensioni dell'istruzione socio -emotiva, importanza, scuola materna »

