Acidi e basi Differenze, caratteristiche, esempi
- 1679
- 271
- Lidia Valentini
IL acidi e basi Sono composti chimici che non presentano una singola definizione, ma diversi, che dipendono dalle caratteristiche o dalle proprietà prese in considerazione. In termini generali, si potrebbe dire che gli acidi sono sostanze acide, mentre le basi sono saponácee o saponi.
Le definizioni più importanti, come Brönsted-Lowry, o Arrhenius, si concentrano maggiormente sul rilascio di ioni H3O+ (Idronio) u oh-(idrossile) da queste sostanze. O nelle sue forme pure o disciolte in acqua.
Una definizione che si presenta come conseguenza di quanto sopra è quanto segue: gli acidi disciolti in acqua generano soluzioni con valori di pH inferiori a 7, mentre le basi disciolte producono soluzioni con valori di pH superiori a 7. Il pH è proprio un modo per esprimere come acido o base sia un liquido che tiene conto della concentrazione di H3O+.
Pertanto, le sostanze acide, come il succo d'arancia, hanno un pH inferiore a 7 e molti ioni H3O+. Mentre le basi, come Legía, hanno un pH maggiore di 7 e molti ioni OH-.
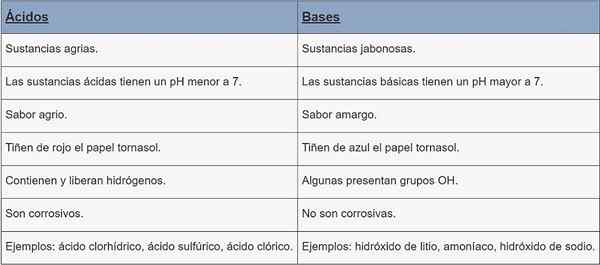
Acidi | Basi | |
Tipo di sostanza | Sostanze agrarie. | Sostanze Jabonesas. |
ph | pH inferiore a 7. | pH maggiore di 7. |
Gusto | Acido. | Amaro. |
Colorazione | Carta spartiacque rossa. | Cornstasol Paper Dye Dye Blue. |
Caratteristiche | Contengono e rilasciano idrogeni. | Alcuni gruppi OH presenti. |
Corrosione | Sono corrosivi. | Non sono corrosivi. |
Esempi | Acido cloridrico, acido solforico, acido clorico. | Idrossido di litio, ammoniaca, idrossido di sodio. |
Acidi
 Il succo d'arancia è uno dei rappresentanti dell'acido più noti della nostra vita quotidiana
Il succo d'arancia è uno dei rappresentanti dell'acido più noti della nostra vita quotidiana Caratteristiche acide
Le sostanze acide hanno alcune caratteristiche:
Sapore aspro
Gli acidi hanno un gusto aspro. Routinely, un tipo di sapore è designato con il termine "acido". Pertanto, si dice che il succo di limone e il liquido di alcune gomme siano acidi, poiché i suoi sapori sono aspri e forti per il palato.
Carta spartiacque rossa
Gli acidi sono sostanze in grado di trasformare il colore del blu in carta spray rossa. Strasol fa parte di un insieme di sostanze che possono cambiare colore in base al grado di acidità o basicità dell'ambiente in cui si trovano. Queste sostanze sono chiamate indicatori di pH.
Può servirti: proprietà coligative delle soluzioniContengono e rilasciano idrogeni
Gli acidi sono composti chimici che hanno l'elemento chimico dell'idrogeno (H), il che gli conferisce caratteristica dell'acidità.
Molte altre sostanze contengono anche idrogeno, ma non possono rilasciarlo come accade con acidi. Quando si libera, l'idrogeno è sotto forma di ione o cation+. Questi h+, Quando si incontrano le molecole d'acqua, vengono aggiunte a queste per formare gli ioni H3O+.
Trasportano la corrente elettrica
A causa di atomi H+ che vengono rilasciati quando gli acidi in acqua vengono sciolti, questi sono in grado di trasportare elettricità attraverso l'uso di batterie o batterie.
Sono corrosivi
Ci sono acidi forti che sono molto corrosivi. Pertanto, il contatto con loro dovrebbe essere evitato, poiché possono causare gravi danni fisici. Anche gli acidi deboli, a concentrazioni molto elevate, come l'acetico (aceto) possono bruciare la pelle e la faringe se i loro vapori vengono respirati.
Forte e debole
Gli acidi forti producono una grande concentrazione di ioni H3O+ Quando si dissolvono nell'acqua. Si dice che gli atomi di idrogeno di acidi forti si dissociano facilmente. Nel frattempo, gli acidi deboli rilasciano pochi atomi di idrogeno e, quindi, producono una concentrazione inferiore di ioni H3O+.
Gli acidi forti hanno un pH molto basso, che a seconda della concentrazione e della forza dell'acido, può essere 1 o meno. Invece, gli acidi deboli hanno un pH acido più elevato, che può essere per esempio 4 o 5.
Gli acidi forti hanno un odore che produce una sensazione di bruciore. Nel frattempo, gli acidi deboli non presentano questo tipo di odore, anche in alcuni casi hanno odori piacevoli. Tuttavia, ci sono molte eccezioni, quindi non sono raccomandati di annusare anche gli acidi deboli.
Può servirti: ossido di ferro (iii): struttura, nomenclatura, proprietà, usiGli acidi forti sono buoni trasportatori di elettricità. Al contrario, gli acidi deboli sono cattivi conduttori di elettricità rilasciando pochi atomi H+.
Gli acidi forti sono in grado di attaccare i metalli, come lo zinco, formando un gran numero di bolle di idrogeno. Questa reazione non è prodotta da acidi deboli.
Esempi di acidi
Acidi forti
-HCL: acido cloridrico
-H2SW4: acido solforico
-HBR: acido bromidrico
-Ciao: acido Yodidrico
-Hno3: acido nitrico
-HCLO4: acido perclorico
-HCLO3: Acido clorico
Acidi deboli
-Cap3COOH: acido acetico
-Hno2: Acido nitroso
-H2Co3: Acido carbonico
-H3Po4: acido fosforico
-C3H5O (COOH): acido citrico
-HF: acido fluoridrico
-H2SW3: Acido solforoso
Basi
 L'ammoniaca è una sostanza di base
L'ammoniaca è una sostanza di base Caratteristiche di base
Le basi presentano le seguenti caratteristiche:
-Producono una sensazione viscosa o sapone nelle dita, facendo sì che gli oggetti vengano presi dalle mani scivolose.
-Hanno un gusto amaro.
-Possono reagire con gli acidi, producendo la formazione di composti chiamati sali. In alcuni casi, questi possono precipitare o affondare nell'acqua. Inoltre, nella reazione di una base con un acido, si forma l'acqua.
-Girano il colore della carta a germogli blu, indicando che la soluzione ha un pH maggiore di 7 o alcalino.
-Alcune basi presenti nei loro gruppi di formula chimica oh, chiamati idrossilli, che sono formati da un atomo di idrogeno e un atomo di ossigeno.
Forte e debole
Le basi forti sono composti chimici che presentano uno o più gruppi OH nella loro struttura chimica, che quando entrano in contatto con l'acqua acquisiscono un carico negativo, OH-.
Nel frattempo, le basi deboli non si presentano nei loro gruppi di idrossili di formula chimica. Tuttavia, basi deboli quando reagisce con acqua produce anche ioni o anioni oh-.
Basi forti, come l'idrossido di sodio, hanno valori di pH molto alti, vicino a 14. Nel frattempo, le basi deboli hanno un pH inferiore, come l'ammoniaca, che ha un pH di 11.
Può servirti: ebollizione: concetto, tipi ed esempiLe basi forti sono usate nelle case per scoprire gli scarichi. Questo è il caso dell'idrossido di potassio. Nel frattempo, le basi deboli vengono utilizzate nei lavori di pulizia, come l'ammoniaca presente in molti detergenti.
Esempi di basi
Basi forti
-Lioh: idrossido di litio
-NaOH: idrossido di sodio
-Koh: idrossido di potassio
-Rboh: idrossido di rubidio
-CSOH: idrossido di cesio
-Sr (oh)2: Idrossido di stronzio
-Ba (oh)2: idrossido di bario
Basi deboli
-NH3: ammoniaca
-Nhet2: dietilammina
-NH2Cap3: Metilamina
-C5H5N: piridina
Differenze tra acidi e basi
Ioni che rilasciano
Acidi Rilasciare gli atomi H+ o h3O+ Quando si dissolvono nell'acqua. Nel frattempo, le basi rilasciano o producono a contatto con ioni d'acqua OH-.
Valori di pH
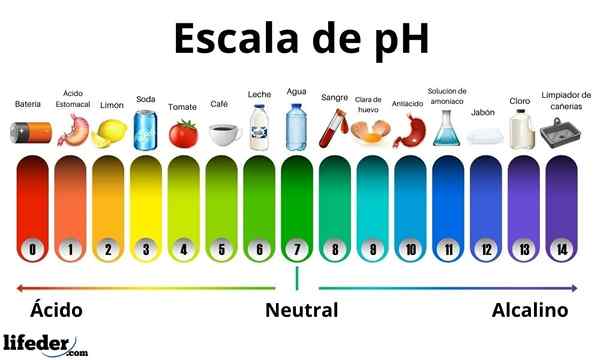
Gli acidi hanno un valore di pH tra 0 e 7. Nel frattempo, le basi hanno un valore di pH tra 7 e 14. Pertanto, gli acidi trasformano il colore della carta a germoglio e le basi lo trasformano in blu.
Reazioni di allenamento
Gli acidi provengono dalla reazione di ossidi di elementi non metallici, ad esempio cloro, zolfo, ecc., Con acqua, o si formano anche quando l'idrogeno è combinato con un elemento non metallico e quindi il composto formato si dissolve in acqua (HF, HCl, HBR, ecc.).
Le basi sono prodotte dalla reazione di ossido di un metallo, ad esempio ferro, rame, magnesio, ecc., Con acqua. Va ricordato che un ossido è la combinazione di atomi di ossigeno con qualsiasi altro elemento chimico.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Helmestine, Anne Marie, PH.D. (11 febbraio 2020). Definizione e esempio acido. Recuperato da: Thoughtco.com
- Esploratori di scienze. (31 luglio 2018). Insegnare ai bambini di acidi e basi. Recuperati da: scientifici esploratori.com
- Esemplatura di redazione. (2013). Caratteristiche acide. Recuperato da: esemplare.com
- Lumen Chemistry for non Majors. (S.F.). Proprietà di acidi e basi. Recuperato da: corsi.Lumenarning.com
- Clark Jim. (2013). Basi forti e deboli. Recuperato da: ChemGuide.co.UK
- « Flora e fauna delle specie rappresentative della Sierra Ecuadoriana
- Framework metodologico come scriverlo, struttura, esempi »

