Struttura, proprietà e usi dell'acido Yodidricato (HI)

- 1730
- 458
- Ruth Cattaneo
Lui acido iaridrico È una soluzione acquosa di ioduro di idrogeno che è caratterizzato dalla sua alta acidità. Una definizione più allegata alla terminologia chimica e all'IUPAC è che è un'idrazia, la cui formula chimica è HI.
Tuttavia, per differenziarlo dalle molecole gassose dell'idrogeno ioduro, HI (G), è indicato come HI (AC). È per questo motivo che nelle equazioni chimiche è importante identificare l'ambiente o la fase fisica in cui sono stati reagenti e prodotti. Anche così, le confusioni tra ioduro di idrogeno e acido iarclorico sono generalmente comuni.
 Ioni acidi iaridici. Fonte: Gabriel Bolívar.
Ioni acidi iaridici. Fonte: Gabriel Bolívar. Se le molecole impegnate vengono osservate nella loro identità, si trovano famigerate differenze tra HI (G) e HI (AC). Nel hi (g), c'è un collegamento H-I; Mentre sono in hi (AC), in realtà sono un paio di ioni i- e h3O+ interagendo elettrostáticamente (immagine superiore).
D'altra parte, l'HI (AC) è una fonte di hi (g), poiché il primo è preparato dalla dissoluzione del secondo in acqua. Per questo motivo, a meno che non sia in un'equazione chimica, HI può anche essere usato per fare riferimento anche all'acido iarchidrico. L'HI è un forte agente riducente e un'ottima fonte di ioni i- In mezzo acquoso.
[TOC]
Struttura dell'acido Yodidrico
L'acido Yodidrico, come spiegato, è costituito da una soluzione di HI in acqua. Essendo in acqua, le molecole HI si dissociano completamente (elettrolita forte), originando gli ioni i- e h3O+. Questa dissociazione può essere rappresentata con la seguente equazione chimica:
Ciao (g) + h2O (l) => i-(AC) + H3O+(AC)
Cosa sarebbe equivalente se scritto come:
Ciao (g) + h2O (l) => hi (ac)
Tuttavia, HI (AC) non rivela affatto ciò che è successo alle molecole gassose Hi; Indica solo che sono in mezzo acquoso.
Pertanto, la vera struttura di hi (AC) è costituita da ioni i- e h3O+ circondato da molecole d'acqua che le idratano; Più concentrato è l'acido iaridico, più basso è il numero di molecole d'acqua senza protone.
Può servirti: Boyle LawCommercialmente, in effetti, la concentrazione di HI è dal 48 al 57% in acqua; Più concentrato sarebbe equivalente ad avere un acido troppo fumato (e ancora più pericoloso).
Nell'immagine, si può vedere quell'anione i- È rappresentato con una sfera viola e h3O+ Con sfere bianche e un rosso, per l'atomo di ossigeno. Il catione h3O+ Presenta la piramide trigonale di geometria molecolare (vista da un piano più alto nell'immagine).
Proprietà
Descrizione fisica
Liquido incolore; Ma puoi esibire toni giallastri e marroni se sei in contatto diretto con l'ossigeno. Questo perché ioni i- Finiscono per ossidare lo iodio molecolare, io2. Se c'è molto io2, È più che probabile che si formi l'anione triaduro3-, che macchia la soluzione come marrone.
Massa molecolare
127,91 g/mol.
Odore
Acro.
Densità
La densità è di 1,70 g/mL per la soluzione HI al 57%; Poiché le densità variano a seconda delle diverse concentrazioni di HI. Questa concentrazione forma un azeotropico (viene distillata come una singola sostanza e non come una miscela) la cui stabilità relativa può essere dovuta alla sua commercializzazione al di sopra di altre soluzioni.
Punto di ebollizione
Il 57% Hi Azeotrope bolle a 127 ° C a una pressione di 1,03 bar (passa a ATM).
PKA
-1.78.
Acidità
È un acido estremamente forte, tanto che è corrosivo per tutti i metalli e i tessuti; Anche per le gomme.
Questo perché il collegamento H-I è molto debole ed è facilmente rotto durante la sua ionizzazione dell'acqua. Inoltre, i ponti idrogeno i- - Hoh2+ Sono deboli, quindi non c'è nulla che interferisca con H3O+ reagire con altri composti; cioè h3O+ ha "gratis", come l'io- Ciò non attira troppo al suo contropiede.
Può servirti: pycnometerAgente riducente
L'HI è un potente agente riducente, il cui prodotto di reazione principale è io2.
Nomenclatura
La nomenclatura dell'acido iaridrico deriva dal fatto che lo iodio "funziona" con un singolo stato di ossidazione: -1. E inoltre, il nome indica che ha acqua all'interno della sua formula strutturale [i-] [H3O+". Questo è il suo unico nome, in quanto non è un composto puro ma una soluzione.
Applicazioni
Fonte di iodio nella sintesi organica e inorganica
L'HI è un'ottima fonte di ioni i- per la sintesi inorganica e organica ed è anche un potente agente riducente. Ad esempio, la sua dissoluzione acquosa del 57% viene utilizzata per la sintesi di iodidi alchilici (come Cho3Cap2I) da alcoli primari. Allo stesso modo, un gruppo OH può sostituire in una struttura da un I.
Agente riducente
L'acido Yodidrico è stato usato per ridurre, ad esempio, i carboidrati. Se il glucosio sciolto in questo acido viene riscaldato, perderà tutti i suoi gruppi OH, ottenendo come prodotto l'idrocarburo N-esano.
Allo stesso modo, è stato usato per ridurre i gruppi funzionali di fogli di grafene, in modo che possano essere funzionalizzati per dispositivi elettronici.
Processo Cativa
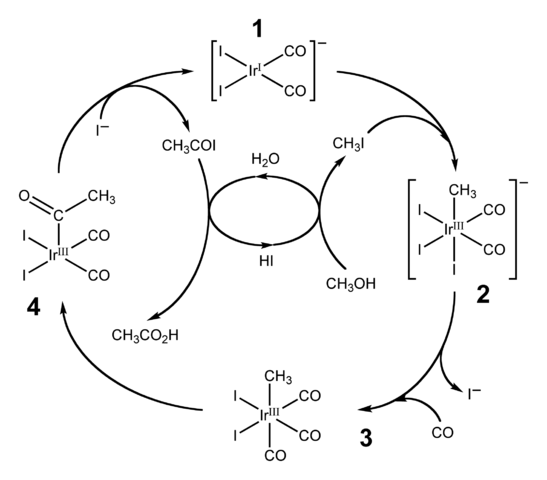 Diagramma del ciclo catalitico per il processo Cativa. Fonte: Ben Mills [dominio di dominio pubblico].L'HI viene utilizzato anche per la produzione industriale di acido acetico attraverso il processo Cativa. Ciò consiste in un ciclo catalitico in cui si verifica la carbonilazione del metanolo; cioè, alla molecola di CH3Oh viene introdotto un gruppo carbonilico, c = o, per trasformarsi in acido Cho3COOH.
Diagramma del ciclo catalitico per il processo Cativa. Fonte: Ben Mills [dominio di dominio pubblico].L'HI viene utilizzato anche per la produzione industriale di acido acetico attraverso il processo Cativa. Ciò consiste in un ciclo catalitico in cui si verifica la carbonilazione del metanolo; cioè, alla molecola di CH3Oh viene introdotto un gruppo carbonilico, c = o, per trasformarsi in acido Cho3COOH.
Passi
Il processo inizia (1) con il complesso organo-iridium [IR (CO)2Yo2"-, di geometria piatta quadrata. Questo composto "riceve" il metil ioduro, ch3Io, prodotto dell'acidificazione Cho3Oh con il 57% di ciao. L'acqua si verifica anche in questa reazione e, grazie ad essa, l'acido acetico si ottiene alla fine, consentendo all'HI di recuperare nell'ultimo passaggio.
Può servirti: colloideIn questo passaggio sia il gruppo -CH3 Mentre il -I si unisce al Centro Metal Ididio (2), formando un complesso ottaedrico con una sfaccettatura composta da tre ligandi e. Uno degli Yodos finisce per sostituirsi con una molecola di monossido di carbonio, CO; E ora (3), il complesso ottaedrico ha una sfaccettatura composta da tre co -ligandi.
Quindi si verifica un riarrangiamento: il gruppo -ch3 Viene "rilasciato" da IR e si unisce all'adiacente (4) per formare un gruppo acetilico, -Coch3. Questo gruppo viene rilasciato dal complesso Iridido per collegarsi agli ioni ioduro e dare a Cho3COI, acetil ioduro. Qui viene recuperato il catalizzatore Iridium, pronto a partecipare a un altro ciclo catalitico.
Finalmente, Cho3COI subisce una sostituzione dell'i- Per una molecola H2Oppure, il cui meccanismo termina rilasciando acido HI e acetico.
Sintesi illecita
 Reazione di riduzione dell'efedrina con fosforico rosso e fosforo a metaphetamina. Fonte: metanfetamina_from_efedrine_with_hi_ru.SVG: Deried Ring0 Trabajo: MaterialScient (Speaking) [Dominio pubblico].L'acido Yodidrico è stato usato per la sintesi della sostanza psicotropica che sfrutta il suo alto potere riduttivo. Ad esempio, è possibile ridurre l'efedrina (un medicinale per il trattamento dell'asma) in presenza di fosforo rosso, in metanfetamina (immagine superiore).
Reazione di riduzione dell'efedrina con fosforico rosso e fosforo a metaphetamina. Fonte: metanfetamina_from_efedrine_with_hi_ru.SVG: Deried Ring0 Trabajo: MaterialScient (Speaking) [Dominio pubblico].L'acido Yodidrico è stato usato per la sintesi della sostanza psicotropica che sfrutta il suo alto potere riduttivo. Ad esempio, è possibile ridurre l'efedrina (un medicinale per il trattamento dell'asma) in presenza di fosforo rosso, in metanfetamina (immagine superiore).
Si può vedere che una sostituzione del gruppo OH da parte dell'I, seguita da un secondo sostituto per un H.
Riferimenti
- Wikipedia. (2019). Acido idroiodico. Recuperato da: in.Wikipedia.org
- Andrews, Natalie. (24 aprile 2017). Gli usi dell'acido idiode. Scientifico. Recuperato da: scientifici.com
- Alfa Aesar, Thermo Fisher Scientific. (2019). Acido idriodico. Recuperato da: Alfa.com
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Acido idriodico. Database PubChem., CID = 24841. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Steven a. Hardinger. (2017). Glossario illustrato della chimica organica: acido idroiodico. Recuperato da: Chem.Ucla.Edu
- Reusch William. (05 maggio 2013). Carboidrati. Recuperato da: 2.Chimica.MSU.Edu
- A Kyu Moon, Junghyun Lee, Rodney S. Ruoff & Hyoyoung Lee. (2010). Ossido di trafene ridotto mediante grafitizzazione chimica. Doi: 10.1038/NCOMMS1067.
- « Caratteristiche, tipi ed esempi di apprendimento memoriali
- Caratteristiche, tipi, vantaggi e fasi di bioprocessi »

