Struttura dell'acido solfidrico (H2S), proprietà, usi, importanza
- 693
- 40
- Silvano Montanari
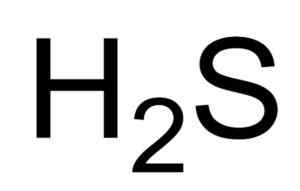
Lui acido solfidrico O Idrogeno solforato è un gas formato dall'unione di un atomo di zolfo (S) e due atomi di idrogeno (H). La sua formula chimica è h2S. È anche noto come gas solfuro. È un gas incolore il cui odore diventa evidente nelle uova marce.
È presente nei vulcani e nelle molle calde solfure, in gas naturale e petrolio greggio. Si forma anche durante la decomposizione anaerobica (senza ossigeno) della materia organica vegetale e animale. Si verifica naturalmente nel corpo dei mammiferi, attraverso l'azione di alcuni enzimi sulla cisteina, un aminoacido non essenziale.
 Formula chimica di acido solfidrico o idrogeno solforato. Saranphong Yimklan [dominio pubblico]. Fonte: Wikimedia Commons.
Formula chimica di acido solfidrico o idrogeno solforato. Saranphong Yimklan [dominio pubblico]. Fonte: Wikimedia Commons. Le soluzioni acquose di H2S sono corrosivi per metalli come l'acciaio. Il h2S è un composto riducente che, quando reagisce con il SO2 , Ossida lo zolfo elementare mentre si riduce a2 Anche allo zolfo.
Nonostante sia un composto altamente tossico e fatale per gli animali e gli animali, per alcuni anni la sua importanza è stata studiata in una serie di importanti processi nel corpo.
Regola una serie di meccanismi relativi alla generazione di nuovi vasi sanguigni e al funzionamento del cuore.
Proteggere i neuroni e hanno pensato alla sua azione da malattie come Parkinson e Alzheimer.
A causa della sua riduzione chimica può combattere le specie ossidanti, agendo contro l'invecchiamento cellulare. Per questi motivi, viene studiata la possibilità di produrre farmaci che quando forniti ai pazienti può rilasciarlo lentamente all'interno del corpo.
Ciò servirebbe a trattare patologie come ischemia, diabete e malattie neurodegenerative. Tuttavia, il loro meccanismo d'azione e la loro sicurezza devono ancora essere studiati in profondità.
[TOC]
Struttura
La molecula H2S è analogo a quello dell'acqua, cioè assomigliano alla loro forma perché gli idrogeni si trovano formando un angolo con lo zolfo.
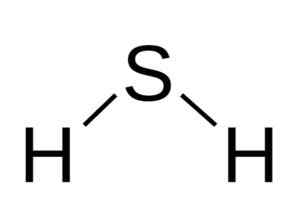 Struttura angolare della molecola di acido solfuro, h2S. Bangin [CC BY-SA 3.0 (http: // creativeCommons.Org/licenze/by-sa/3.0/]]. Fonte: Wikimedia Commons.
Struttura angolare della molecola di acido solfuro, h2S. Bangin [CC BY-SA 3.0 (http: // creativeCommons.Org/licenze/by-sa/3.0/]]. Fonte: Wikimedia Commons. Zolfo in h2S ha la seguente configurazione elettronica:
1s2, 2s2 2 p6, 3s2 3p6,
Quindi prendi un elettrone di ciascun idrogeno per completare il suo strato di valenza.
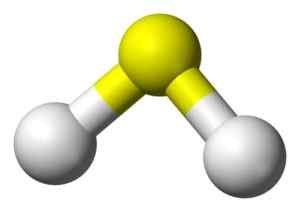 Struttura 3D di acido solfuro. Giallo: zolfo. Bianco: idrogeno. Benjah-BMM27 [dominio pubblico]. Fonte: Wikimedia Commons.
Struttura 3D di acido solfuro. Giallo: zolfo. Bianco: idrogeno. Benjah-BMM27 [dominio pubblico]. Fonte: Wikimedia Commons. Nomenclatura
- Acido solfidrico
- Idrogeno solforato
- Idruro di zolfo.
Proprietà fisiche
Stato fisico
Gas incolore di odore molto spiacevole.
Peso molecolare
34,08 g/mol.
Punto di fusione
-85,60 ºC.
Punto di ebollizione
-60,75 ºC.
Densità
1.1906 g/l.
Solubilità
Solubile in acqua moderatamente: 2,77 volumi in 1 acqua a 20 ºC. Può essere sfrattato completamente dalla soluzione acquosa inviandola a ebollizione.
Proprietà chimiche
In soluzione acquosa
Quando l'idrogeno solforato è in soluzione acquosa, viene assegnato il nome dell'acido solfidrico. È un acido debole. Ha due protoni ionizzabili:
H2S + h2O ⇔ h3O+ + Hs-, KA1 = 8,9 x 10-8
Hs- + H2O ⇔ h3O+ + S2-, KA2 ∼ 10-14
Il primo protone è leggermente ionizzato, come può essere dedotto dalla sua prima costante di ionizzazione. Il secondo protone è molto poco ionizzato, ma le soluzioni di H2S contengono qualcosa dell'anione di zolfo s2-.
Se la soluzione H2S è esposto all'aria, il o2 Oxida a solfuro anionico e zolfo precipitati:
Può servirti: ossidi2 s2- + 4 h+ + O2 → 2 h2O + 2 s0↓ (1)
In presenza di cloro CL2, Bromo Br2 e iodio i2 Si forma l'idrogeno e lo zolfo corrispondenti:
H2S + Br2 → 2 HBR + S0↓ (2)
Le soluzioni acquose di H2S sono corrosivi, producono crepe di stress con solfuro in acciai alti duri. I prodotti di corrosione sono ferro e idrogeno solforato.
Reazione di ossigeno
Il h2S reagisce con l'ossigeno dell'aria e possono verificarsi le seguenti reazioni:
2 h2S + 3 o2 → 2 h2O + 2 SO2 (3)
2 h2S + o2 → 2 h2O + 2 s0↓ (4)
Reazione con i metalli
Reagisce con vari metalli che si spostano sull'idrogeno e formano solfuro di metallo:
H2S + Pb → PBS + H2↑ (5)
Reazione con biossido di zolfo
Nei gas vulcanici gli H sono presenti2S e così2, che reagiscono tra loro e si forma lo zolfo solido:
H2S + SO2 → 2 h2O + 3 s0↓ (6)
Decomposizione con la temperatura
L'idrogeno solforato non è molto stabile, è facilmente rotto dal riscaldamento:
H2S → H2↑ + s0↓ (7)
Posizione nella natura
Questo gas si trova naturalmente nelle molle calde solfideiche o solfurose, in gas vulcanici, in petrolio greggio e gas naturale.
 Acqua solforosa manuale. Николай максимович [cc di 3.0 (https: // creativeCommons.Org/licenze/di/3.0)]. Fonte: Wikimedia Commons.
Acqua solforosa manuale. Николай максимович [cc di 3.0 (https: // creativeCommons.Org/licenze/di/3.0)]. Fonte: Wikimedia Commons. Quando il petrolio (o il gas) contiene tracce significative di H2Si dice che S sia "aspro", in contrasto con "dolce", che è quando non lo contiene.
Piccole quantità di h2S in petrolio o gas sono economicamente dannosi perché un impianto di lavaggio deve essere installato per rimuoverlo, sia per prevenire la corrosione che per rendere il gas residuo sicuro per l'uso domestico come combustibile.
Si verifica ogni volta che la materia organica che contiene zolfo è decomposta in condizioni anaerobiche (assenza di aria), come gli animali umani, gli animali e i rifiuti vegetali.
 H Emissioni2S (colore verde bluastro) sulla costa della Namibia, fotografata dalla NASA. Queste emissioni provengono da rifiuti organici. Osservatorio di terra della NASA [CC di 2.0 (https: // creativeCommons.Org/licenze/by/2.0)]. Fonte: Wikimedia Commons.
H Emissioni2S (colore verde bluastro) sulla costa della Namibia, fotografata dalla NASA. Queste emissioni provengono da rifiuti organici. Osservatorio di terra della NASA [CC di 2.0 (https: // creativeCommons.Org/licenze/by/2.0)]. Fonte: Wikimedia Commons. I batteri presenti in bocca e nel tratto gastrointestinale lo producono dai materiali degradabili che contengono verdure o proteine animali.
Il suo odore caratteristico fa avvisare la sua presenza nelle uova marce.
Il h2S si verifica anche in alcune attività industriali, come nelle raffinerie di petrolio, forni di coca cola, fabbriche di carta, che avresti e nella trasformazione alimentare.
Sintesi nel corpo dei mammiferi
Il h2S endogeno può verificarsi nei tessuti dei mammiferi, tra questi essere umani, da due percorsi, un enzimatico e non enzimatico.
Il percorso non enzimatico consiste nel ridurre lo zolfo elementare0 a h2S attraverso l'ossidazione del glucosio:
2 c6H12O6 (glucosio) + 6 s0 (zolfo) + 3 h2O → 3 c3H6O3 + 6 h2S + 3 co2 (8)
Può servirti: cloro: storia, proprietà, struttura, rischi, usiIl percorso enzimatico è costituito da h h2S dalla l-cisteina, che è un aminoacido sintetizzato dal corpo. Il processo è assicurato da diversi enzimi, come la cistallo.
 L'acido solfidrico è stato trovato nel cervello delle mucche. Autore: Artower. Fonte: Pixabay.
L'acido solfidrico è stato trovato nel cervello delle mucche. Autore: Artower. Fonte: Pixabay. Ottenere in laboratorio o industrialmente
Idrogeno (h2) e gli elementi di zolfo non reagiscono alle normali temperature ambientali, ma sopra di questi iniziano a essere combinati, la temperatura ottimale è di 310 ºC.
Il processo è comunque troppo lento, quindi altri metodi vengono utilizzati per ottenerlo, tra questi seguenti.
I solfuri metallici (come il solfuro ferroso) stanno reagendo con acidi (come cloridrico) in soluzione diluita.
Fes + 2 HCl → FECL2 + H2S ↑ (9)
In questo modo si ottiene il gas2S che, data la sua tossicità, deve essere raccolta in modo sicuro.
Uso industriale di H2S per produrre zolfo
Stoccaggio e trasporto in grandi quantità di h2S che si separa dal gas naturale lavando con ammine è difficile, quindi il processo del claus viene utilizzato per trasformarlo in zolfo.
 Nelle raffinerie di petrolio la h è separata2S di gas naturale lavando con ammine e poi diventa zolfo. Autore: Satyaprem. Fonte: Pixabay.
Nelle raffinerie di petrolio la h è separata2S di gas naturale lavando con ammine e poi diventa zolfo. Autore: Satyaprem. Fonte: Pixabay. In questo processo si verificano due reazioni. Nel primo la H2S reagisce con l'ossigeno per darlo2, Come accennato sopra (vedi Reazione 3).
Il secondo è una reazione catalizzata dall'ossido di ferro dove il SO2 è ridotto e h2S ossidati e i due producono zolfo (vedi Reazione 6).
In questo modo, si ottiene lo zolfo, che può essere facilmente immagazzinato e trasportato, oltre a allocare a più usi.
Utilità o importanza di H2S endogeno nell'organismo
Il h2S Endogen è quello che si verifica naturalmente nell'organismo come parte del normale metabolismo negli esseri umani, mammiferi e altri esseri viventi.
Nonostante la sua lunga reputazione di essere un gas tossico e velenoso associato alla decomposizione della materia organica, diversi studi recenti dagli anni 2000 ad oggi hanno stabilito che H2S Endogen è un importante regolatore di alcuni meccanismi e processi nell'essere vivente.
Il h2S presenta un'elevata lipofilicità o affinità nei confronti dei grassi, quindi attraversa facilmente le membrane cellulari, penetrando su tutti i tipi di cellule.
Sistema cardiovascolare
Nei mammiferi, l'acido solfuro promuove o regola una serie di segnali che regolano il metabolismo, la funzione cardiaca e la sopravvivenza cellulare.
Esercita un potente effetto sul cuore, sui vasi sanguigni e sugli elementi circolanti del sangue. Modula il metabolismo cellulare e la funzione mitocondriale.
Difende i reni del danno causato dall'ischemia.
Sistema gastrointestinale
Svolgere un ruolo importante come fattore protettivo contro il danno alla mucosa gastrica. Si stima che sia un importante mediatore della motilità gastrointestinale.
È probabile che sia coinvolto nel controllo della secrezione di insulina.
Sistema nervoso centrale
Agisce anche in importanti funzioni del sistema nervoso centrale e protegge i neuroni dello stress ossidativo.
 I neuroni sono protetti da H2S endogeno. Autore: Gerd Altmann. Fonte: Pixabay.
I neuroni sono protetti da H2S endogeno. Autore: Gerd Altmann. Fonte: Pixabay. Si stima che possa proteggere dalle malattie neurodegenerative come Parkinson, Alzheimer's e Hunginton's Disease.
Organo di visione
Proteggi le cellule dei fotorecettori dalla degenerazione della retina indotta dalla luce.
Può servirti: carbonato di litio (Li2CO3): struttura, proprietà, usiContro l'invecchiamento
Il h2Essere una specie riducente può essere consumata da una varietà di agenti ossidanti che circolano nel corpo. Combatti specie ossidanti come specie reattive dell'ossigeno e specie reattive di azoto nel corpo.
Limitare le reazioni dei radicali liberi attraverso l'attivazione di enzimi antiossidanti che proteggono dagli effetti dell'invecchiamento.
Potenziale di guarigione di H2S fornito esogeno
La biodisponibilità di H2S Endogenico dipende da alcuni enzimi coinvolti nella biosintesi della cisteina nei mammiferi.
Alcuni studi suggeriscono che un donatore di terapia farmacologica Don2S potrebbe essere utile per alcune patologie.
Ad esempio, potrebbe essere utile nei pazienti diabetici, poiché è stato osservato che i vasi sanguigni degli animali diabetici migliorano con i farmaci che forniscono H2S esogeno.
Il h2S fornito esogeno aumenta l'angiogenesi o la formazione di vasi sanguigni, quindi potrebbe servire per il trattamento delle malattie dell'ischemia cronica.
Vengono ideati i farmaci che possono rilasciare h2S lentamente essere in grado di agire beneficialmente su varie malattie. Tuttavia, l'efficacia, la sicurezza e i meccanismi della loro azione devono ancora essere studiati.
Rischi
Il h2S è un veleno fatale se viene inalato puro o addirittura diluito 1 parte del gas in 200 parti d'aria. Gli uccelli sono molto sensibili a H2S e muori anche in diluizione di 1 su 1500 parti di aria.
 Acido solfuro o idrogeno solforato H2S è un veleno potente. Autore: Openicons. Fonte: Pixabay.
Acido solfuro o idrogeno solforato H2S è un veleno potente. Autore: Openicons. Fonte: Pixabay. Il h2S è un potente inibitore di alcuni enzimi e processi di fosforilazione ossidativa, che porta al soffocamento cellulare. La maggior parte delle persone lo percepisce in modo olfiterato in concentrazioni superiori a 5 ppb (parti per miliardo). Le concentrazioni di 20-50 ppm (parti per milione) sono irritanti per gli occhi e il tratto respiratorio.
Un'inalazione di 100-250 ppm per alcuni minuti può generare mancanza di coordinamento, disturbi della memoria e disturbi motori. Quando la concentrazione è di circa 150-200 ppm2S. Se una concentrazione di 500 ppm viene inalata per 30 minuti, è possibile produrre edema polmonare e polmonite.
Le concentrazioni di oltre 600 ppm possono essere fatali entro i primi 30 minuti, poiché il sistema respiratorio è paralizzato. E 800 ppm è la concentrazione che è immediatamente letale per l'essere umano.
Pertanto, si dovrebbe evitare che ci siano fughe H2S nei laboratori, locale o ovunque o situazione.
È importante avvisare che si verifichino molti decessi perché le persone entrano in spazi confinati per salvare colleghi o familiari che sono crollati a causa dell'avvelenamento con H2S, morire anche loro.
È un gas infiammabile.
Riferimenti
- Panthi, s. et al. (2016). Importanza fisiologica dell'idrogeno solforato: neuroprotettore e neuromodulatore emergente e neuromodulatore. Medicina ossidativa e longevità cellulare. Volume 2016. ID articolo 9049782. Hyndawi si è ripreso.com.
- Shefa, u. et al. (2018). Funzioni antiossidanti e di segnalazione cellulare dell'idrogeno solforato nel sistema nervoso centrale. Medicina ossidativa e longevità cellulare. Volume 2018. ID articolo 1873962. Hyndawi si è ripreso.com.
- Tabassum, r. et al. (2020). Importanza terapeutica dell'idrogeno solforato nelle malattie neurodegenerative associate all'età. Neural Regen Res 2020; 15: 653-662. Nronline recuperato.org.
- Martelli, a. et al. (2010). Idrogeno solforato: nuova opportunità per la scoperta di farmaci. Recensioni di ricerca medicinale. Volume 32, numero 6. Estratto dalla biblioteca online.Wiley.com.
- Wang, m.-J. et al. (2010). Meccanismi di angiogesi: ruolo dell'idrogeno solforato. Farmacologia e fisiologia clinica e sperimentale (2010) 37, 764-771. Estratto dalla biblioteca online.Wiley.com.
- Dalefield, r. (2017). Fumo e altri tossiconti inalati. Idrogeno solforato. In veterinaria tossicologia per l'Australia e la Nuova Zelanda. Recuperato da ScienceDirect.com.
- Selley, R.C. e Sonnenberg, s.A. (2015). Le proprietà fisiche e chimiche del petrolio. Idrogeno solforato. In Elements of Petroleum Geology (terza edizione). Recuperato da ScienceDirect.com.
- Hocking, m.B. (2005). Zolfo e acido solforico. Claus Process Conversione di idrogeno solforato in zolfo. Nel manuale di tecnologia chimica e controllo dell'inquinamento (terza edizione). Recuperato da ScienceDirect.com.
- Lefer, d.J. (2008). Potenziale importanza delle alterazioni dell'idrogeno solforato (H2S) biodisponibilità nel diabete. British Journal of Pharmacology (2008) 155, 617-619. Estratto da bpspubs.Biblioteca online.Wiley.com.
- O.S. Biblioteca nazionale di medicina. (2019). Idrogeno solforato. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov.
- Porta, j.A. e Ibarz, J. (1965). Chimica generale moderna. 7a edizione. Editoriale di Marín, s.A.
- « Origine dell'istruzione socialista, caratteristiche, principi, esempi
- Storia del teatro neoclassico, caratteristiche, rappresentanti, opere »

