Acido fosforico (H3PO4)
- 1775
- 161
- Rosolino Santoro
 Molecola di acido fosforico individuale
Molecola di acido fosforico individuale Cos'è l'acido fosforico?
Lui acido fosforico È un acido oxo del fosforo che ha una formula chimica H3Po4. È costituito da un acido minerale in cui tre protoni acidi sono legati all'anione fosfato (PO43-). Sebbene non sia considerato un forte acido, il suo uso inappropriato può avere un rischio per la salute.
Può essere trovato in due stati: come solido sotto forma di cristalli ortorrombici spessi o come liquido che guarda lo sciroppo cristallino. La sua presentazione commerciale più normale ha una concentrazione dell'85% di p/p e una densità di 1.685 g/cm3. Questa densità deriva dalla mano della concentrazione.
I tre gruppi OH sono responsabili della donazione di idrogeni acidi. A causa della loro presenza nella loro struttura, è possibile reagire con diversi idrossidi causando diversi sali.
Nel caso dell'idrossido di sodio, puoi formare tre: fosfato monobasico di sodio (NAH2Po4), Fosfato di sodio dibasico (NA2HPO4) e fosfato di sodio tribasico (NA3Po4).
Tuttavia, a seconda della base utilizzata per la neutralizzazione o quali cationi sono molto vicini ad essa, è possibile formare altri sali di fosfato. Tra questi ci sono: fosfato di calcio (CA3(Po4)2), Fosfato di litio (li3Po4), fosfato ferrico (FEPO4), e altri. Ciascuno con i suoi diversi gradi di protonazione dell'anione fosfato.
D'altra parte, l'acido fosforico può "rapire" cationi bivalenti come la fede2+, Cu2+, AC2+ e mg2+. Ad alte temperature puoi reagire con te stesso con la perdita di una molecola H2O formando diametri, trimmer e polimeri di acidi fosforici.
Questo tipo di reazione rende questo composto in grado di stabilire un gran numero di strutture con scheletri di fosforo e ossigeno, da cui è possibile ottenere anche una vasta gamma di sali noti, come i polifosfati.
Per quanto riguarda la sua scoperta, fu sintetizzato nel 1694 da Robert Boyle (1627-1691), dissolvendo P2O5 (Pentossido di fosforo) in acqua. È uno degli acidi minerali più utili, essendo la sua funzione come fertilizzante la più importante.
Il fosforo, il potassio e l'azoto costituiscono i tre principali nutrienti delle piante.
Struttura dell'acido fosforico chimico
 Struttura dell'acido fosforico chimico
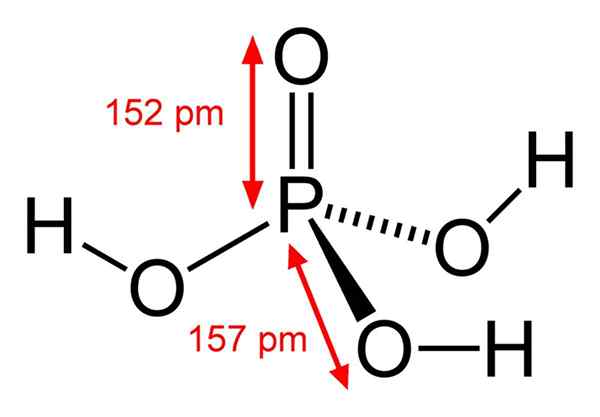
Struttura dell'acido fosforico chimico L'acido fosforico è costituito da un legame p = O. Con l'atomo di fosforo al centro, l'ossigeno disegna una sorta di tetraedro molecolare.
In questo modo, l'acido fosforico può essere visualizzato come tetraedro. Da questo punto di vista questi tetraedri (di H unità3Po4) interagire tra loro con ponti idrogeno; Cioè, i loro vertici si avvicinano da vicino.
Queste interazioni intermolecolari consentono l'acido fosforico cristallico in due solidi: anidro e emiidrato (H3Po4· 1/2h2O), entrambi con sistemi cristallini monoclinici. La sua forma Anhydra può anche essere descritta con la formula: 3H2O · p2O5, che è uguale a un pentossido di fosforo tri-idratato.
Tetraedra può persino collegare in modo covalente, ma per questa una delle sue unità deve eliminare una molecola d'acqua attraverso la disidratazione. Questo si verifica quando h3Po4 Subisce il riscaldamento e genera di conseguenza la formazione di acidi polifosferici (PA).
Acido diposforo (H4P2O7)
Il più semplice di tutti i PA è l'acido diposforico (h4P2O7), noto anche come acido pirofosforico. L'equazione chimica della formazione è la seguente:
Può servirti: fosfato in alluminio (ALPO4): struttura, proprietà, ottenimento, usi2h3Po4 H4P2O7 + H2O
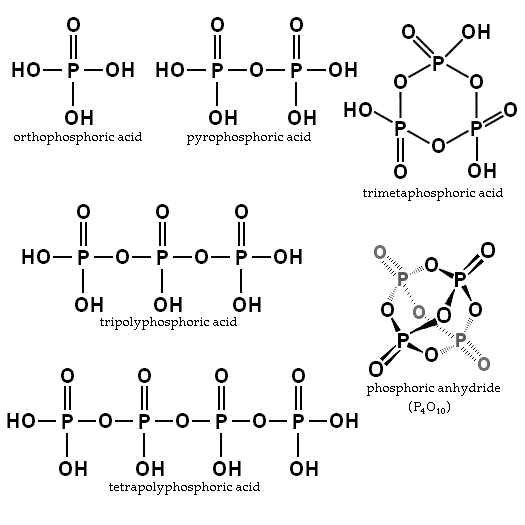
L'equilibrio dipende dalla quantità di acqua e temperatura. Qual è la sua struttura? Nell'immagine della sezione le strutture dell'acido ortofosfaico e pirofosforico sono illustrate nell'angolo in alto a sinistra.
Due unità si uniscono in modo covalente quando viene eliminata una molecola d'acqua, formando un ponte di ossigeno P-O-P tra di loro. Ora non sono tre idrogeno acido, ma quattro (quattro gruppi -OH). Per questo motivo, h4P2O7 Presenta quattro costanti K KA.
Acidi polifosforici
La disidratazione può continuare con l'acido pirofosforico se il riscaldamento continua. Perché? Perché ad ogni estremità della sua molecola c'è un gruppo OH che può essere eliminato come molecola d'acqua, promuovendo così la successiva crescita dello scheletro P-o-o-o-p ... P ..
Esempi di questi acidi sono acidi trimfosforici e tetropolifforici (entrambi illustrati anche nell'immagine precedente). Si può vedere come lo scheletro p-o-p si allungano in una sorta di catena formata da tetraedri.
Questi composti possono essere rappresentati con la formula HO (PO2OH)XH, dove ho è l'estremità sinistra che può disidratare. Po2Oh è lo scheletro di fosforo con i collegamenti P = O e OH; E x sono le unità di acido fosforico o le molecole necessarie per ottenere detta catena.
Quando questi composti sono completamente neutralizzati, i polifosfati così chiamati. A seconda dei cationi circondati, formano un'ampia varietà di sali di polifosfato.
D'altra parte, se reagiscono con gli alcoli ROH, gli idrogeni del loro scheletro vengono sostituiti dai sostituenti alchilici r-. Pertanto, sorgono esteri fosfato (o polifisari): RO (PO2O)XR. È sufficiente sostituire l'H con R tutte le strutture dell'immagine della sezione per ottenerle.
Acidi polifosforici ciclici
Le catene P-O-P possono anche essere chiuse in un anello o in un ciclo fosforico. Il più semplice di questo tipo di composto è l'acido trimetafosforico (l'angolo in alto a destra dell'immagine). Pertanto, PAS può essere lineare, ciclico; o se le loro strutture presentano entrambi i tipi, ramificate.
Nomenclatura
 Acido fosforico. Fonte: Comuni.Wikimedia.org
Acido fosforico. Fonte: Comuni.Wikimedia.org La nomenclatura dell'acido fosforico è governata da Iupac e come sono nominati i sali di nullion di oxoacidi.
Perché in h3Po4 L'atomo di P ha Valencia +5, quello con il massimo valore, al suo acido viene assegnato il suffisso -ico al prefisso del fosforo-.
Orto-
Tuttavia, l'acido fosforico viene anche comunemente raccontato acido ortofosforico. Perché? Perché la parola "orto" è greca e significa "vera"; che comporterebbe la "vera forma" o "più idratata" dello stesso.
Quando l'anidro fosforico è idratato con un eccesso di acqua (P4O10, Il cappuccio "immagine superiore" ")3Po4 (3h2O · p2O5). Pertanto, il prefisso orto viene assegnato a quegli acidi formati con acqua abbondante.
Piro-
Il prefisso di Piro- si riferisce a ogni composto originato dopo l'applicazione del calore, poiché l'acido diposforico deriva dalla disidratazione termica dell'acido fosforico. È quindi chiamato acido pirofosforico (2h2O · p2O5).
Obiettivo-
Il prefisso target, che è anche una parola greca, significa "dopo". Viene aggiunto a quelle sostanze la cui formula ha eliminato una molecola, in questo caso, quella dell'acqua:
H3Po4 => HPO3 + H2O
Si noti che questa volta non si verifica l'aggiunta di due unità fosforiche per formare l'acido diposforico, ma invece che si ottiene l'acido metafosforico (da cui non vi è alcuna evidenza della sua esistenza).
Può servirti: alcol etilico: struttura, proprietà, usi, ottenimentoÈ anche importante evidenziare che questo acido può essere descritto come h2O · p2O5 (Simile all'emidrato, moltiplicando HPO3 Per 2). Il prefisso meta- è perfettamente secondo il PA ciclico, poiché se l'acido trfosforico diventa disidratato, ma non aggiunge un'altra unità h3Po4 Per diventare acido tetraphosforico, allora devi formare un anello.
E questo è lo stesso con altri acidi polimetofosforici, sebbene l'IUPAC consigli di chiamarli come composti ciclici del PAS corrispondente.
Proprietà dell'acido fosforico
Formula molecolare
H3Po4
Peso molecolare
97.994 g/mol
Aspetto fisico
Nella sua forma solida presenta cristalli ortorrombici, igroscopici e trasparenti. In forma liquida è cristallino, con un aspetto di sciroppo viscoso.
Commercialmente si ottiene in soluzione acquosa con una concentrazione dell'85% P/P. In tutte queste presentazioni manca l'odore.
Punti di ebollizione e fusione
158º C (316º F A 760 mmHg).
108º F (42,2º C).
Solubilità dell'acqua
548 g/100 g di H2O 20º C; 369,4 g/100 ml a 0,5º C; 446 g/100m a 14,95º C.
Densità
1.892 g/cm3 (solido); 1.841 g/cm3 (Soluzione al 100%); 1.685 g/cm3 (Soluzione 85%); 1.334 g/cm3 Soluzione 50%) a 25 ° C.
Densità del vapore
Air relative 3.4 (aria = 1).
Auto -accensione
Non è infiammabile.
Sostanza vischiosa
3,86 mpoise (dal 40% a 20º C).
Acidità
PH: 1,5 (soluzione 0,1 N in acqua)
PKA: PKA1 = 2.148; PKA2 = 7.198 e PKA3 = 12.319. Pertanto, il suo idrogeno più acido è il primo.
Decomposizione
Quando viene riscaldato, rilascia ossidi di fosforo. Se la temperatura sale a 213º C o più diventa acido pirofosforico (H4P2O7).
Corrosività
Corrosivo a metalli ferrosi e alluminio. Quando reagi con questi metalli, ha origine gas combustibile con idrogeno.
Polimerizzazione
Polimeriza violentemente con composti di bufala, epossidi e composti polimerizzabili.
Usi di acido fosforico
Fosfat e generali usano le vendite
-L'acido fosforico funge da base per l'elaborazione del fosfato, che sono usate come fertilizzanti perché il fosforo è un nutriente principale delle piante.
-È stato utilizzato nel trattamento di avvelenamento leader e altre condizioni in cui sono necessarie importanti quantità di fosfato e la produzione di acidosi lieve.
-Viene utilizzato per controllare il pH del tratto urinario di visoni e gatti al fine di evitare la formazione di calcoli renali.
-L'acido fosforico provoca sali2HPO4 e nah2Po4 che costituiscono un sistema di ammortizzatore di pH con un PKA di 6,8. Questo sistema regolatorio del pH è presente nell'uomo, con importanza nella regolazione del pH intracellulare, nonché nella gestione della concentrazione di idrogeno nei tubuli distale e collettore dei nefroni.
-È usato nell'eliminazione dello strato mohosa di ossido di ferro che si accumula su questo metallo. L'acido fosforico forma fosfato di ferro, che può essere facilmente rimosso dalla superficie del metallo. Viene anche utilizzato nel lucido elettrico in alluminio.
Industriali
-L'acido fosforico è destinato come agente catalitico nell'elaborazione di nylon e benzina. È usato come agente disidratante nell'incisione litografica, nell'elaborazione dei coloranti per l'uso nell'industria tessile, nel processo di coagulazione del lattice nell'industria della riva e nella purificazione del perossido di idrogeno (perossido di idrogeno (perossido di idrogeno).
-L'acido viene usato come additivo nelle bevande analcoliche che contribuiscono in questo modo al suo sapore. Diluito, viene applicato nel processo di raffinazione dello zucchero. Agisce anche come un sistema di ammortizzatore nella preparazione di prosciutto, gelatina e antibiotici.
Può servirti: idrossido di alluminio: struttura, proprietà, usi, rischi-Interviene nell'elaborazione dei detergenti, nella catalisi acida della produzione di acetilene.
-È usato come acidulante negli alimenti bilanciati per l'industria del bestiame e gli animali domestici. L'industria farmaceutica lo utilizza nella produzione di farmaci antidemetici. Approfitta anche di una miscela per preparare l'asfalto per aprire il terreno e riparare le crepe.
-L'acido fosforico funge da catalizzatore nella reazione di idratazione degli alcheni per produrre alcol, principalmente etanolo. Inoltre, viene utilizzato nella determinazione del carbone organico nei suoli.
Dentale
Viene utilizzato dai dentisti per pulire e condizionare la superficie dentale prima del posizionamento dei supporti dentali. Trova anche uso nello sbiancamento dentale e l'eliminazione delle piastre dentali. Inoltre, viene utilizzato nella produzione di colla per protesi dentali.
Cosmetici
L'acido fosforico viene utilizzato per regolare il pH nell'elaborazione dei prodotti cosmetici e per la cura della pelle. È usato come agente ossidante chimico per la produzione di carbonio attivo.
Formazione di acido fosforico
-L'acido fosforico viene preparato da rocce fosfato di tipo apatite, per mezzo della sua digestione concentrata di acido solforico:
AC3(Po4)2 + 3 h2SW4 + 6 h2O => 2 h3Po4 + 3 (Caso4.2h2O)
L'acido fosforico ottenuto in questa reazione è a bassa purezza, quindi subisce un processo di purificazione che include tecniche di precipitazione, estrazione di solvente, cristallizzazione e scambio di ioni.
-L'acido fosforico può verificarsi dissolvendo il pentossido di fosforo in acqua bollente.
-Può anche essere ottenuto riscaldando il fosforo con una miscela di vapore aria e acqua:
P4 (l) +5 o2 (g) => p4O10 (S)
P4O10 (s) +H2O (g) => 4h3Po4 (L)
Rischi
-Poiché la pressione del vapore è bassa a temperatura ambiente, è improbabile che i tuoi vapori possano essere inalati, a meno che l'acido non venga spruzzato. In tal caso, i sintomi della loro inalazione includono: tosse, mal di gola, respirazione di breve durata e laboriosa.
-In letteratura viene citato il caso di un marinaio esposto ai vapori di acido fosforico per un lungo periodo di tempo. Ha sofferto di debolezza generale, tosse secca, dolore toracico e problemi respiratori. Dopo un anno dopo la mostra, è stata osservata una disfunzione reattiva del tratto respiratorio.
-Il contatto cutaneo con acido fosforico può causare arrossamento, dolore, vesciche e ustioni della pelle.
-Il contatto dell'acido con gli occhi, a seconda della sua concentrazione e della durata del contatto, può produrre in questi, lesioni corrosive tissutali o gravi ustioni con danno oculare permanente.
-L'ingestione acida provoca bruciatura in bocca e gola, sensazione di ardore oltre lo sterno, il dolore addominale, il vomito, lo shock e il collasso.
Riferimenti
- Royal Society of Chemistry. (2015). Acido fosforico. Preso da: Chemspider.com
- Centro canadese per la salute e la sicurezza sul lavoro. (1999). Acido fosforico - Effetti sulla salute. Preso da: CCSSO.AC
- Acidi.Informazioni. (2018). Acido fosforico "Varietà di usi di questo composto chimico. Tratto da: acidi.Informazioni
- James P. Smith, Walter E. Brown e James R. Lehr. (1955). Struttura dell'acido fosforico cristallino. J. SONO. Chimica. Soc. 77, 10, 2728-2730
- Wikipedia. (2018). Acidi fosforici e fosfati. Preso da: in.Wikipedia.org
- La scienza è divertente. Scopri l'acido fosforico. [PDF]. Preso da: Scifun.Chimica.Wisc.Edu

